4.1. Механизмы биологического действия низкоэнергетического лазерного излучения на организм человека
Лечение светом имеет многовековую традицию. Об использовании естественного света в лечении большого числа заболеваний можно прочесть во многих древних трактатах по медицине. Искусственный свет стал активно использоваться в медицине в ХХ в. Создание в середине прошлого столетия лазерных генераторов и исследования влияния лазерного света на биологические ткани послужило толчком для рождения новой медицинской отрасли – лазерной медицины.
Первые публикации по светотерапии относятся еще к XIX в.: монография Э. Бэббитта «Принципы света и цвета. Исцеляющая сила цвета» была опубликована в 1878 г., работа Н. Финзена «Светолечение» – в 1901 г., труд В. Бика «Применение света в медицине – в 1906 г., «Руководство по светолечению» В. Хаусманна – в 1929 г. Значительный вклад в развитие светотерапии внес американский физиолог Диншах Хадиали (1873–1966).
Свет является одновременно электромагнитными волнами и потоком частиц, для которых характерна высокая частота (10–14 Гц) и малая длина волны, определяемая в нм (1нм= 10–9 м) или в мкм (1мкм=10–6 м). Спектр электромагнитных волн представлен тремя диапазонами: инфракрасное излучение – от 400 до 0,76 мкм (40000–760 нм), видимое излучение – от 0,76 до 0,4 мкм (760–400 нм); ультрафиолетовое излучение – от 0,4 до 0,18 мкм (400–180 нм). Именно длина волны в первую очередь определяет глубину проникновения света в биологические ткани. А характер и интенсивность взаимодействия света с биологическими тканями зависит от энергии порции излучения-кванта, которая прямо пропорциональна частоте электромагнитных колебаний и обратно пропорциональна длине волны.
Световое излучение видимого спектра издавна использовалось и по сей день применяется в хирургии и травматологии для ускорения заживления ран.
Изучение эффектов влияния света на организм ведется в разных странах. Так, в недавних исследованиях ученых из Германии Andrei P. Sommer и Dang Chju обнаружено, что при воздействии интенсивного света ежедневно в течение нескольких недель кожа становится более эластичной и выглядит моложе, цвет лица улучшается, а глубина морщин значительно уменьшается. По мнению этих исследователей, молекулы белка эластина, формирующие эластичную основу кожи, могут гидратироваться – покрываться своеобразной «пленкой» из молекул воды – и вследствие этого частично утрачивать свою упругость, что приводит к снижению эластичности кожи. Видимый свет большой интенсивности, испускаемый светодиодами, проникает в толщу кожи и постепенно отщепляет воду от эластиновых волокон, возвращая коже упругость.
В исследованиях Frank M?ckel (Германия) доказано, что облучение инфракрасным светом проблемных зон у женщин (живот и бедра) стимулирует обмен веществ и усиливает расщепление жира, который сжигается во время тренировки на велотренажере.
Согласно данным исследований специалистов Бар-Иланского университета (Рамат-Гана, Израиль) и больницы «Меир» (Кфар-Саба, Израиль) видимые световые лучи повышают активность спермы и могут благотворно повлиять на результаты лабораторных процедур по оплодотворению яйцеклеток. Свет способствует преобразованию молекулярного кислорода в его активные формы, и именно они, судя по всему, способствуют росту подвижности сперматозоидов. Световое воздействие приводят к увеличению активности протеинкиназы А – фермента, ответственного за ряд ключевых функций клеток спермы.
Вне всякого сомнения, светолечение – перспективная область физиотерапии, которая будет развиваться и далее.
Гипотеза о возможности получения эффекта индуцированного излучения, лежащего в основе работы квантовых генераторов, впервые была выдвинута еще А. Эйнштейном в 1918 г. Но только после фундаментальных исследований советских ученых Н. Г. Басова и А. М. Прохорова и американских физиков С. Townes, J. Goroon, H. Leigen, выполненных в 1950-х гг., были заложены теоретические основы лазеров (термин «лазер» составлен из первых букв словосочетания «Light Amplificated by Stimuleited of Emission Radiation», означающего: «усиление света с помощью эффекта индуцированного излучения»).
Первый лазерный генератор на кристалле искусственного рубина был создан в 1960 г. T. Maiman и применен в медицине для лечения сетчатки глаза в 1962 г… Тогда же в СССР и США создается новый тип лазеров – полупроводниковый [М. Т. Александров, 1991].
Первые исследования биологической активности низкоэнергетического лазерного излучения были проведены профессором В. М. Инюшиным и его сотрудниками в 1964 г.
В отечественной медицине лазеры стали использоваться с конца 60-х годов ХХ в. В этот период появляются, в частности, сообщения об успешном использовании гелий-неоновых лазерных терапевтических аппаратов в лечении заболеваний нервной системы у детей [Т. М. Шакирова, В. В. Жуковская, 1969]. Позднее публикуются результаты исследований по применению низкоэнергетических лазеров в лечении заболеваний опорно-двигательного аппарата воспалительного и дегенеративно-дистрофического характера, переломов костей с замедленной консолидацией [Л. А. Мазо, Б. А. Броэр, 1976; В. В. Чаплинский, А. А. Мороз, П. М. Гусар, 1978; У. Я. Богданович, 1980; М. А. Берглезов, В. В. Вялько, И. С. Коростылева, 1984; В. Е. Илларионов, 1984; и др. ] и издаются методические рекомендации по применению лазеров в травматологии и ортопедии [У. Я. Богданович с соавт., 1980; М. А. Берглезов с соавт, 1985; К. С. Терновой с соавт., 1982]. Лазерная терапия предлагается как один из методов лечения ран и язв [E. Mester, 1974, 1980; В. Н. Кошелев, 1980], заболеваний слизистой рта [Д. Л. Корытный, 1980], дерматологических заболеваний [В. П. Ракчеев, 1984] и т. д.
Лазерное излучение является особым видом светового излучения электромагнитной природы, полученным с помощью оптических квантовых генераторов – лазеров. Применение лазеров в медицине основано на эффектах взаимодействия лазерного света с живым организмом и его тканями. Фотобиологические эффекты лазерного излучения зависят, с одной стороны, от параметров лазерного излучения (длины волны и количественных показателей потока световой энергии), с другой – от физиологических свойств самого объекта, подвергающегося воздействию лазерного излучения.
Характеризуя общие механизмы действия лазерного излучения на биологический объект, важно отметить, что лазерное излучение обладает уникальными физическими свойствами – монохроматичность, когерентность, поляризованность, малая расходимость потока излучения. Монохроматичность (хроматичность – ширина спектра электромагнитного излучения) лазерного света характеризуется чрезвычайно узкой полосой, не доступной для получения в других генераторах светового излучения, лимитирована только длиной волны, генерируемой лазерным излучателем. Когерентность – упорядоченность распределения фаз лазерного излучения в пространстве и времени. Поляризованность – лазерное излучение может быть охарактеризовано энергетическим вектором, величина и направление которого в данной точке пространства регулярно меняются, но всегда ориентированы перпендикулярно к направлению лазерного излучения [М. Т. Александров, 1991].
Эти свойства лазерного излучения обуславливают его сложное влияние на организм человека, так как оно несет в себе целый ряд факторов воздействия. Среди последних выделяют непосредственно лазерные факторы воздействия: электромагнитные излучения (световое воздействие); термическое воздействие; механическое воздействие (давление света, ударная волна); и факторы, определяемые свойствами облучаемого биологического объекта: оптические характеристики тканей (коэффициенты отражения, пропускания, поглощения) (отмечено, что наименьшей оптической плотностью обладают биологические ткани для длин волн 0,7–1,4 мкм, т. е. в красном и в ближнем инфракрасном диапазоне [В. И. Корепанов, 1995]); электрические свойства тканей; механические свойства тканей; биохимические свойства тканей; другие физико-химические свойства [М. Т. Александров, 1991; М. Т. Александров с соавт., 1992].
При падении лазерного излучения на поверхность биологического объекта незначительная его часть отражается, остальная проникает в ткани, где поглощается, преломляясь и «рассеиваясь». Биологические ткани способны поглощать кванты лазерного излучения [A. Chasin, 1976], и, согласно закону Эйнштейна-Старка, при поглощении каждого фотона образуется активированная частица (атом, молекула, свободный радикал) [T. Ohshiro et al., 1985; T. Ohshiro, K. G. Calderhead, 1988]).
Известно, что биофизические и биохимические процессы в тканях и жидких средах протекают двухфазно: в медленной фазе происходит количественное накопление массы вещества и (или) энергии, а в быстрой – ее (их) качественное изменение (для энергии изменение ее уровня, для вещества – изменение структуры или массы). Чередование фаз в норме протекает в виде регулярного ритмичного процесса. Патологический процесс нарушает ритмику метаболических систем, возникает «энергетический голод». Дефицит энергии может быть устранен двумя путями: восстановлением деятельности информационных систем либо непосредственным включением энергии в метаболические процессы [В. И. Корепанов, 1995].
В. М. Инюшин (1967), пытаясь теоретически осмыслить механизмы действия низкоэнергетического лазерного излучения на ткани живого организма, выдвинул концепцию «биополя» и «биоплазмы». Он считал, что низкоэнергетическое лазерное излучение при воздействии на ткани организма обуславливает резонансное возбуждение энергетической системы организма без нарушения энергетической конфигурации его микроструктур. В последующих публикациях В. М. Инюшина и его соавторов представлена гипотеза о реализации биологических эффектов лазерного излучения в результате его непосредственного действия на структуру воды и биологические жидкие среды.
С. Д. Захаров с соавт. (1989) утверждал, что биологическое действие лазерного излучения обусловлено генерацией синглетного кислорода, что обеспечивает неселективную регуляцию биохимических процессов.
Е. А. Фролова, С. А. Пермяков (2010) считают, что механизм действия ближнего инфракрасного лазерного излучения на ткани организма определяется малой энергией его квантов. По их мнению, данная энергия, поглощенная биологическими тканями, превращается в колебательную энергию молекул эндогенного кислорода, достаточную для активации ферментов, играющих роль триггеров при запуске физиологических реакций на тканевом уровне, а генерация (под воздействием лазерного излучения) синглетного кислорода будет приводить к изменению свойств клеточных мембран, изменению антигенных свойств органов и тканей, а также к перекисному окислению циклических и алифатических соединений. Следовательно, по мнению Е. А. Фроловой, С. А. Пермякова (2010), характер реакций тканей организма в данном случае будет зависеть от концентрации синглетного кислорода, которая напрямую связана с дозой лазерного воздействия. Те же авторы утверждают, что сочетание низкоэнергетического импульсного инфракрасного лазерного излучения, непрерывного инфракрасного излучения светодиодов и постоянного магнитного поля синергетически изменяет физические свойства клеточных мембран.
В. Е. Кузьмичев с соавт. (1996) считают, что квант света увеличивает колебательную энергию многоатомных биологических молекул, становясь источником энергии, используемой в биохимических процессах.
С. Е. Павлов (2008, 2012 и др.) утверждает, что в основе всех эффектов действия на живой биологический объект низкоэнергетического лазерного излучения лежит принцип «возбуждения» фотонами электронов атомов и молекул микроструктур организма (квантовый характер излучения и поглощения энергии электромагнитного поля был постулирован М. Планком в 1900 г.). Именно в связи с этим вполне легитимно называть лазерную медицину квантовой медициной. Низкоэнергетическое лазерное излучение (не более 100 мВт/см2) влияет на энергетический потенциал молекул: его действие отражается на кинетике биохимических процессов [N. Basor, A. Oraevsky et al., 1987; В. И. Корепанов, 1993].
Эффекты действия лазерного излучения на живые биологические объекты не связаны с селективным поглощением фотонов специфическим белком, как это преподносится рядом авторов [В. В. Осипов с соавт., 1991]. Согласно современным представлениям взаимодействие лазерного света с биологическими структурами осуществляется на уровне химических связей [М. А. Никулин с соавт., 1990]. Одной из гипотез, объясняющих действие лазерного излучения на биологические ткани, является рабочая гипотеза, предложенная В. Е. Илларионовым (1992) и названная им «концепцией биоэлектрического триггера». Согласно этой гипотезе лазерное излучение изменяет электрический статус клетки, включая тем самым триггер (переключатель), который переводит биологическую систему из одного стационарного энергетического состояния в другой. В мембранах клеток имеются системы гигантских по напряжению электрических диполей. Поступающая извне энергия в виде фотонов нарушает равновесие и освобождает заключенную в диполях электрическую энергию, которая используется для осуществления биохимических процессов [Х. Э. Карабаев с соавт., 1988; В. Е. Илларионов, П. А. Дулин, 1992; В. И. Корепанов, 1995]. Заслуживают пристального внимания и другие исследования, в которых развита гипотеза «триггера» – основанная на данных о трансформации под влиянием лазерного излучения кислорода биотканей в активную (синглетную) форму, которая в условиях аэробиоза активирует биохимические процессы в тканях [А. В. Никандров, 1986; В. И. Корепанов, 1995].
В. И. Корепанов (1995) считает, что кванты лазерного света «заставляют» биофизические и следующие за ними биохимические процессы работать не только с ускорением, но и с повышением коэффициента эффективности.
По мнению В. А. Мостовникова с соавт. (1991), в основе фотофизического механизма, ответственного за биологическую активность низкоинтенсивного лазерного излучения, лежит светоиндуцированная переориентация молекулярных (ферменты) и субмолекулярных жидкокристаллических структур в электрическом поле световой волны лазера.
Механизм терапевтического воздействия низкоинтенсивного лазерного света может быть связан с изменением физических свойств межклеточного вещества [В. Ф. Новиков, Т. А. Яхно, 1988].
Отдельные авторы считают, что причина ряда биофизических и физиологических эффектов лазеротерапии заключается в неспецифической структурной альтерации основной метаболической среды организма – водной матрицы. В подтверждение данной теории приводится установленный факт многоступенчатой фотодиссоциации воды под действием низкоэнергетического лазерного излучения и фотоиндуцирование условий в водном растворе для развития Габера-Вейса подобных реакций [В. И. Орлов, В. П. Шабаев, 1991].
В формировании ответной реакции на лазерное излучение важную роль играют мембранные структуры клетки, являющиеся естественными границами раздела фаз. Лазерный свет вызывает переориентацию полярных групп их липидного биослоя. Благодаря тесному контакту в мембранах между липидами и белками конфирмационные изменения липидного слоя могут влиять на процессы, так или иначе связанные с мембранами: энергопродукцию клеток, иммунные и ферментативные реакции [С. Н. Головин, 1994].
Так или иначе, в результате лазерного воздействия в облученных тканях первично происходят следующие биоэнергетические, биохимические и другие физико-химические изменения: поглощение кванта света тканевым акцептором – образование электронного возбуждения – миграция энергии электронного возбуждения – возникновение возбужденных состояний молекул – образование свободных радикалов – стереохимическая перестройка молекул. Эти первичные эффекты ведут к целому ряду вторичных изменений на различных уровнях организации биологического объекта, часть из которых связана с изменением электрического поля клетки, химизма ткани, активацией ферментных систем, в частности сукцинатдегидрогеназы, НАД.Н2, НАДФ.Н2 и др. Не исключено, что лазерное излучение непосредственно воздействует на ферментные системы и рецепторный аппарат клетки и организма. Другая часть вторичных эффектов связана с трансформацией лазерного излучения в другие виды энергии (возникновение нелинейных оптических эффектов, акустических и ультразвуковых колебаний, мягкого ультрафиолетового и рентгеновского излучений), что приводит к еще большему усилению вторичных эффектов и увеличению их разнообразия [М. Т. Александров, 1991].
Интимные механизмы фотофизического и фотохимического действия лазерного излучения на биологические ткани можно условно разделить на субклеточный и клеточный уровни [В. И. Корепанов, 1995]. На органном уровне отмечаются: уменьшение длительности фаз воспаления, уменьшение интерстициального отека, повышение порога чувствительности рецепторов, увеличение поглощения тканями кислорода, повышение скорости кровотока, закрытие шунтов и увеличение количества новых сосудистых образований, активация транспорта продуктов метаболизма через сосудистую стенку. Кроме первичных и вторичных эффектов в организме возникают ответные нейрорефлекторные и нейрогуморальные реакции: активизируется симпатоадреналовая и иммунная системы, увеличивается концентрация адаптивных гормонов, т. е. возникает комплекс адаптационных и компенсаторных реакций в целостном организме.
Таким образом, под воздействием лазерного излучения происходят изменения, которые регистрируются на всех уровнях организации живой материи: субклеточном, клеточном, тканевом, органном, системном [М. А. Никулин с соавт., 1990; Н. Ф. Гамалея с соавт., 1991; А. Н. Курзанов, 1991; М. Т. Александров с соавт., 1992; В. Е. Илларионов, П. А. Дулин, 1992].
А. С. Потапов с соавт. (1991) пишет, что эффект лазеротерапии зависит от исходного уровня клеточного метаболизма, плотности энергии на сеанс и длительности курса лечения.
О. Ю. Воронина с соавт. (1991) утверждают, что лазерное излучение оказывает на организм воздействие, приводящее к повышению неспецифической резистентности организма, т. е. вызывает в нем неспецифические адаптационные реакции. Те же авторы говорят о неодноплановом влиянии лазерного излучения на организм больных в терапевтическом стационаре. Так, у больных с проявлениями исходно повышенной функциональной активности эндокринной системы лазерная терапия оказывала выраженное нормализующее действие. У больных с исходно низким содержанием гормонов в крови наблюдается достоверное повышение сниженных показателей, что позволяет говорить о стимулирующем влиянии лазерного излучения у этой категории больных. При нормальном гомеостазе не выявлено какого-либо влияния на него в связи с лазерным воздействием.
Нельзя согласиться с мнением И. Н. Даниловой с соавт. (1988), утверждавших, что эффект низкоэнергетического лазерного излучения «формируется нейрогуморальным путем, в основном за счет местных процессов в органах и тканях, и в меньшей степени – через стимуляцию систем адаптации, через восстановление резервных возможностей и компенсаторных механизмов организма». Данное высказывание связано с некими собственными абсурдными представлениями авторов о принципах адаптации человеческого организма.
По мнению А. Н. Курзанова (1991), первичная фотоинициация или фотосупрессия универсальных функциональных блоков (транспортных, энергезирующих, ферментных, рецепторных, циклазных и др.) запускает как местные, так и общеорганизменные каскадные реакции регуляторных воздействий, направленных на активацию систем неспецифической резистентности, т. е. в основе терапевтического действия низкоинтенсивного лазерного излучения лежат универсальные механизмы организменного уровня, реализующиеся при участии системы регуляторных пептидов и других надклеточных биорегуляторов.
В основе получаемых при лазеротерапии изменений лежит стимулирующий эффект [И. Н. Ушкова с соавт., 1988]. Низкоэнергетическое лазерное излучение, меняя биоэнергетические параметры тканей, стимулирует в них метаболические процессы [И. Л. Кручинина с соавт., 1988]. Доказано, что под влиянием лазерного облучения крови происходит стимуляция тканевого дыхания [В. В. Кузьменко с соавт., 1992; В. В. Осипов с соавт., 1991], ферментных систем [М. Т. Александров с соавт., 1992; В. В. Грубник с соавт., 1992], белкового и липидного обменов [М. П. Павловский с соавт., 1988; Т. С. Агеева с соавт., 1991; Ю. Ф. Крылов, 1991; А. С. Потапов, В. В. Банкова, 1991]. Отдельные авторы говорят об улучшении кислородтранспортной функции эритроцитов, увеличении их сродства к кислороду и увеличении кислородной емкости крови [А. А. Киршин с соавт., 1991; В. И. Козлов, 1991; М. Т. Александров с соавт., 1992]. Под воздействием лазерного облучения крови происходит значительное (до 64 %) увеличение кислорода, используемого тканями организма для своей жизнедеятельности из протекающей через них крови [В. И. Козлов, 1991; А. Н. Курзанов, 1991; В. П. Зуев, Г. Н. Рыбальченко, 1992]. В митохондриях печени крыс под влиянием низкоинтенсивного лазерного излучения происходят регистрируемые изменения переноса электронов по дыхательной цепи [В. И. Елисеенко с соавт., 1991].
При повышенной вязкости крови, агрегационной активности эритроцитов и тромбоцитов, низкой деформируемости эритроцитов проявляется способность низкоэнергетического лазерного излучения нормализовать эти показатели [В. И. Вахтин, В. Я. Генюк, Г. Н. Сорокин, О. Е. Минаков, 1999], повышать деформируемость эритроцитов [Г. М. Капустина, 1997] и стабилизировать их мембраны [А. Б. Бучарская, Т. Ю. Гроздова, С. Ю. Балакирева, Ю. В. Черненков, 1997]. Улучшение эластических свойств эритроцитов объясняется интенсификацией синтеза макроэргов, а уменьшение агрегационной способности эритроцитов – изменением равновесия процессов притяжения и отталкивания (создающихся одноименными отрицательными электрическими зарядами карбоксильных групп сиаловой кислоты, входящей в состав мембранных гликопротеидов) в сторону преобладания сил отталкивания [Е. В. Бородулина, А. В. Кректун, Н. Г. Ратанова, 1993].
Облучение in vitro лазером донорской крови активизирует систему антиоксидантной защиты, что подтверждено дозазависимым увеличением оксидантной активности церулоплазмина до 115 % от исходной и достоверным возрастанием интегральной супероксиддисмутазной активности плазмы [М. С. Плужников с соавт., 1991]. Лазерное излучение является высокоэффективным активатором каталазной активности в организме, обеспечивает утилизацию продуктов перекисного окисления липидов в обменных процессах, создает условия для быстрой стабилизации мембран [Р. Н. Павлова, О. А. Кузнецова и др., 1992].
Эффекты внутривенного лазерного облучения крови у здоровых людей могут реализовываться посредством интенсификации естественно протекающих метаболических процессов [В. И. Корепанов, 1995]. В. Е. Илларионов (1994) пишет о преимущественной эффективности красного и инфракрасного лазерного излучения (по сравнению с лазерным излучением других длин волн) в плане стимулирующего влияния при большей проникающей способности инфракрасного света, что подтверждается данными биофотометрических исследований тканей различных органов и систем [М. Т. Александров, 1991]. Отмечается прирост тестостерона, прогестерона и эстрадиола в процессе лазерной терапии [А. В. Картелищев с соавт., 1991]. Многократное транскутанное лазерное воздействие в импульсном режиме на яичники крыс оказывает стимулирующий эффект на фолликулярный аппарат и усиливает продукцию половых гормонов [В. А. Гребенников с соавт., 1991]. Указывается целесообразность использования лазерной терапии при снижении уровня рецепции к гормонам в тканях [М. Н. Побединский с соавт., 1992].
Отмечено повышение синтетической активности ядерного аппарата лимфоцитов при лазерном облучении крови, причем соотношение РНК/ДНК превышало исходный уровень в среднем на 20 % [В. А. Юдин с соавт., 1988]. При облучении донорской крови in vitro лазером в течение 1–15 мин усиливаются процессы пролиферации и синтеза ДНК лимфоидными клетками [Е. Ю. Лоцманова с соавт., 1992]. При локальном действии низкоинтенсивного лазерного излучения изменения клеток свидетельствовали об активизации их пролиферации, дифференцировки и специфичности функций. При региональном использовании лазера выявлены изменения, связанные как с непосредственным влиянием его на клетки, так и опосредованные, обусловленные влиянием активизированных клеток на другие структуры, не испытавшие прямого лазерного воздействия [И. М. Байбеков, 1992].
Исследователи из Vanderbilt University (США) сообщают о дозазависимой реакции нервных тканей в ответ на инфракрасное лазерное воздействие. Метод лазерной нейростимуляции ими предлагается использовать взамен метода электростимуляции нейронов – в медицинской практике и научных исследованиях.
Экспериментальные и клинические исследования позволили выяснить, что низкоинтенсивное лазерное излучение нормализует микроциркуляцию: активизирует работу миоцитов и эндотелиоцитов, стимулирует функциональную активность капилляров за счет их дилатации и раскрытия резервных капилляров [И. И. Сивков с соавт., 1988; Г. А. Азизов с соавт., 1991; Б. Н. Жуков с соавт., 1991; А. Н. Карнеев с соавт., 1992; В. И. Козлов, 1991]. При повторных сеансах лазерной терапии наблюдается увеличение капиллярной сети – неоваскулогенез [В. И. Козлов, 1991]. Отмечается, что под влиянием лазерного излучения скорость регенерации микрососудов увеличивается в два раза [В. И. Козлов, 1991; В. И. Корепанов, 1995]. В. И. Козлов, В. А. Буйлин (1993) утверждают, что в основе биостимулирующего эффекта низкоэнергетического лазерного излучения лежит активация микроциркуляции за счет увеличения объемного тканевого кровотока при включении резервных микрососудов и повышении кровотока в приносящих артериолах. М. Т. Александров с соавт. (1992) считает, что микроциркуляторные реакции – это индивидуально выраженные организменные реакции, интегрально характеризующие состояние изучаемого органа, ткани, системы органов и целостного организма.
Убедительно доказано положительное влияние низкоэнергетического лазерного излучения на реологические свойства крови [Б. С. Брискин с соавт., 1991; В. И. Козлов, 1991; В. П. Авдошкин, 1992; М. Т. Александров, 1992; Л. Н. Картусова с соавт., 1992]; при этом отмечалась нелинейная дозазависимость происходящих изменений [Б. С. Брискин с соавт., 1991; Г. Е. Брилль с соавт., 1991; В. И. Козлов с соавт., 1992]. Биохимические исследования показали, что лазерное облучение крови ликвидирует предтромботические состояния, снижает концентрацию фибриногена и усиливает фибринолитическую активность. В результате применения низкоинтенсивного лазерного излучения отмечается увеличение реологического индекса, усиление пульсового кровотока, ускорение кровотока и «просветление» капилляроскопического фона, выявляется умеренная гипокоагуляция [В. И. Корепанов, 1995].
При оценке результатов лазерного воздействия внимание большого числа исследователей привлекают изменения со стороны форменных элементов крови [Р. Н. Павлова с соавт., 1992]. Накоплены многочисленные факты благоприятного влияния лазерного излучения на форменные элементы крови [В. И. Корепанов, 1995]. Г. В. Плаксина с соавт. (1990) свидетельствуют, что курсовое лазерное облучение у больных с вегетативными полинейропатиями приводит к положительным сдвигам функционального состояния крови и, следовательно, к улучшению адаптационно-защитных реакций организма. Об изменениях в лейкоцитарной формуле с возрастанием процентного содержания лимфоцитов на 20–30 % у больных с патологией пародонта после курса лазерного облучения крови говорится в отдельных работах [З. М. Рудых с соавт., 1991]. Выявлено увеличение количества эритроцитов и содержания гемоглобина, нормализация количества неизмененных красных кровяных телец (дискоцитов) и снижение содержания патологических форм (эхиноцитов, стоматоцитов), а также дегенеративно-измененных клеток [В. И. Корепанов, 1995]. Воздействие излучения лазера на цельную кровь in vitro приводило к структурно-конформационным изменениям гемоглобина, вследствие чего увеличивалось сродство к кислороду неоксигенированных групп гемоглобинов [Л. Н. Картусова с соавт., 1992].
Одним из системных воздействий низкоэнергетического лазерного излучения является его влияние на процессы иммуногенеза, причем, как общего, так и местного [В. И. Корепанов, 1995]. Лазерное излучение вызывает увеличение продукции и количества циркулирующих иммуноглобулинов, влияет на количество Т– и В-лимфоцитов, а внутри первых – на соотношение киллеров, хелперов и супрессоров [Н. Ф. Гамалея с соавт., 1991]. Изучение суточных колебаний чувствительности натуральных киллеров и фагоцитирующих лейкоцитов к излучению лазера in vitro показало, что лазерное воздействие в большей степени активировало клетки, выделенные в моменты наименьшей их активности [Н. Ф. Гамалея с соавт., 1991]. Имеются данные о модификации иммунного ответа под влиянием лазерного облучения крови [Н. Ф. Гамалея с соавт., 1991; В. И. Корепанов, 1995]. При изучении действия низкоинтенсивного лазерного излучения инфракрасного диапазона было обнаружено усиление продукции интерлейкина-1 [В. И. Елисеенко с соавт., 1991].
О. Д. Иванов и соавт. (1976), облучая лазером очаги ограниченного нейродермита и локализованного зуда (экспозиция – 3 мин, на курс 25–30 ежедневных процедур) констатировали выраженный терапевтический эффект у 33,9 %, улучшение – у 62,3 % больных. Лучшие результаты наблюдали у больных с локализованным кожным зудом, а также при давности заболевания до 3 лет.
По данным В. А. Мерзлякова, Г. Э. Шинского (1984), лечение лазером ограниченных форм зудящих дерматозов (выходная мощность 20 мВт, экспозиция на один очаг – 3–8 мин, число очагов за сеанс – не более трех, на курс – 30 ежедневных сеансов), приводило к полному регрессу высыпаний в течение 23 дней. У больных с исходной эозинофилией после облучений отмечалась нормализация данного показателя.
М. Л. Карагезян и соавт. (1986) проводили лазерную терапию больным диффузным и ограниченным нейродермитом. На эритематосквамозные высыпания воздействовали излучением с плотностью мощности 2 мВт/см2, экспозицией 10 мин; на очаги выраженной лихенификации – соответственно 5 мВт/см2 и 8 мин; всего 2–3 курса по 25–30 процедур каждый. У 11,1 % больных отмечали клиническое выздоровление, у 62,5 % – значительное улучшение. Ремиссия от 6 мес. до 1 года продолжалась у 56 %, от 1 до 3 лет – у 25 % больных. В группе сравнения клинического выздоровления не наблюдалось, обострение заболевания возникало у большинства пациентов через 3–5 мес. Во всех случаях лазеротерапия приводила к восстановлению функциональных дефектов нейтрофилов: повышению содержания катионных белков, миелопероксидазы, снижению активности щелочной и нормализации кислой фосфатаз. В группе больных ограниченным нейродермитом отмечалось также улучшение показателей Т-клеточного иммунитета [М. Л. Карагезян, Н. Г. Комиссарова, И. Л. Нестерова, 1986; М. Л. Карагезян, Н. Г. Комиссарова, Д. Л. Климова, 1988].
Экспериментальные и клинические исследования свидетельствуют об изменении под воздействием низкоэнергетического лазерного излучения энергетической активности и конформационного состояния клеточных мембран [О. Г. Астафьева, Г. Е. Брилль, С. Г. Петрышева, Т. П. Романова, 1992], активации ядерного аппарата клеток [Г. Е. Брилль, Н. П. Панина, А. Е. Сигарева, 1992], основных ферментных систем [А. В. Архангельский, О. Г. Астафьева, 1982; А. С. Крюк, В. А. Мостовников, И. В. Хохлов, Н. С. Сердюченко, 1986; Д. Р. Ракитина, А. К. Ушмаров, Е. А. Строев, В. Я. Гармаш, 1994], биосинтетических [С. М. Зубкова, О. А. Крылов, 1976] и окислительно-восстановительных процессов [И. Б. Лапрун, 1981; К. М. Пагава, И. Ф. Минеев, А. В. Пагава и др., 1988; И. М. Корочкин, Е. В. Бабенко, 1990], структурно-функциональных преобразованиях межклеточного пространства, увеличении продукции макроэргических соединений [Н. А. Богуш, В. А. Мостовников, А. Т. Пикулев, 1981; S. Passarella, F. Camassima, S. Milinary et al., 1984; В. А. Доровских, Е. А. Бородин, Г. П. Бородина и др., 1999], повышении митотической активности клеток. Это обеспечивает быстрые темпы физиологической и репаративной регенерации [И. Н. Данилова, 1985; В. И. Попова, 1985], формирование комплексных нервно-рефлекторных и нейрогуморальных реакций [L. M. Brunetand et al., 1979; J. Baum, 1986; L. M. Brunetaud, V. Maunoury, S. Mordon, 1986; В. И. Козлов, 1999]. При этом важно знать, что низкоэнергетическая лазеротерапия, не изменяющая внутримолекулярные связи, не обладает мутагенным действием и не вызывает патологических изменений морфологической структуры тканей [T. Ohshiro, K. G. Calderhead, 1988].
Лазерное излучение низкой интенсивности изменяет процессы перекисного окисления липидов в направлении образования меньших количеств конечных продуктов окисления [Ю. И. Гринштейн, 1997; Т. А. Золотарева, А. Я. Олешко, Т. И. Олешко, 2001].
В эксперименте изучали динамику индивидуальных показателей УПП (нейроэнергокартирование; омегаметрия) головного мозга испытуемого в ответ на лазерное низкоэнергетическое воздействие на кожные проекции сонных артерий [С. Е. Павлов, А. С. Ващенко, Т. Н. Павлова, 2015].
Показатели УПП, полученные с помощью метода нейроэнергокартирования (рис. 5), в центральном отведении после лазерного стимулирования повысились с 18 мВ до 27 мВ.
Показатели УПП, полученные с помощью метода омегаметрии (рис. 6), после повторного лазерного стимулирования повысились с 16 мВ до 18 мВ – за временной промежуток 10 мин. На основании результатов проведенных экспериментов сделан вывод о том, что низкоэнергетическое лазерное воздействие на кожные проекции сонных артерий оказывает стимулирующее влияние на энергообмен головного мозга.
Ученые из Arizona State University (США) разработали лазерную технологию, позволяющую уничтожать патогенные вирусы и бактерии в крови человека, не затрагивая здоровые клетки. Новая методика может быть использована в лечении таких заболеваний, как СПИД и гепатит, сообщает Journal of Physics. Исследователи под руководством профессора Kong-Thon Tsen применяли фемтосекундные импульсы инфракрасного лазера. Эти импульсы создавали критические вибрации белковых оболочек бактерий и вирусов, что приводило к их разрушению. Эксперименты, проведенные американскими физиками, подтвердили, что эти вибрации не наносят вреда клеткам человека. Такая избирательность связана с различиями в строении белковых оболочек микроорганизмов и клеток человеческих тканей. Разработанная методика может быть использована для лечения тяжелых, устойчивых к антибиотикам инфекций, а также в качестве метода дезинфекции донорской крови и биоматериалов [www.medlinks.ru].
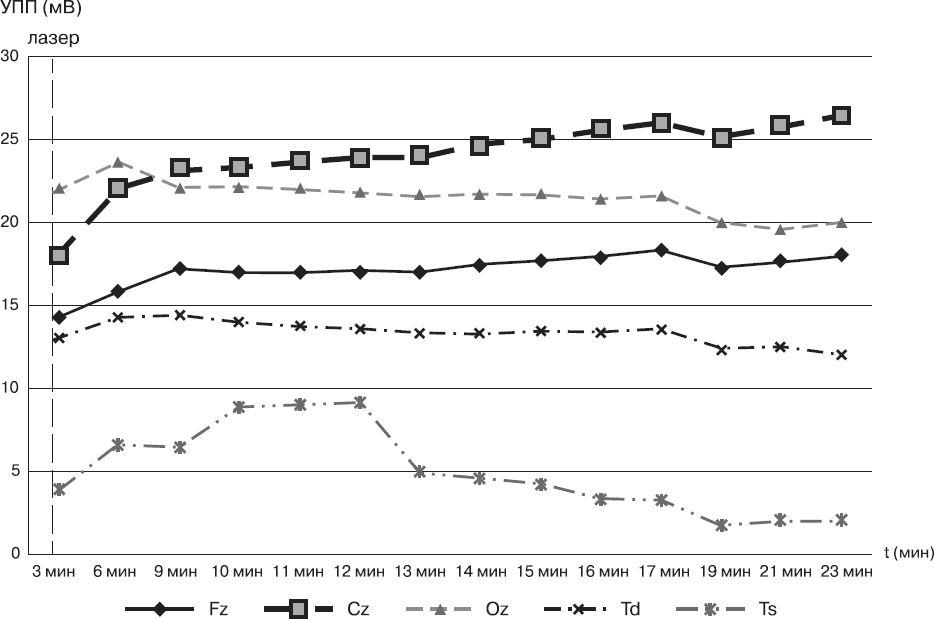
Рис. 5. Индивидуальные показатели УПП (нейроэнергокартирование) испытуемого при лазерном низкоэнергетическом воздействии: Fz – лобное отведение, Cz – центральное (затылочное) отведение, Oz – теменное отведение, Td – правое височное отведение, Ts – левое височное отведение
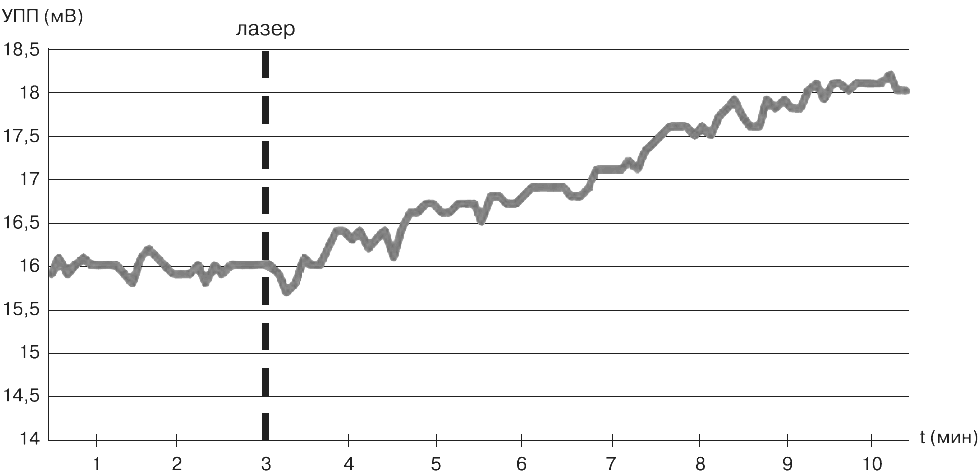
Рис. 6. Индивидуальные показатели УПП (омегаметрия) испытуемого при лазерном низкоэнергетическом воздействии
Под действием низкоэнергетического лазерного излучения изменяется ультраструктура нервных клеток [Т. А. Аджимолаев, С. М. Зубкова, О. А. Крылов, З. А. Соколова, 1979]. В условиях лазерного воздействия усиленно функционирует ядерный аппарат нейронов, повышается их энергетический обмен, происходит фотостимуляция ультраструктуры синапсов. При этом лазерное воздействие снижает чувствительность рецепторного аппарата [J. J. Bishko, 1980; В. П. Туманов, Е. В. Глущенко, Г. Г. Серов и др. 1994].
Исследователи из University of California (США) предлагают использовать лазерное излучение в лечении больных наркоманией. Предварительные эксперименты продемонстрировали, что метод может быть весьма многообещающим для лечения наркоманов с тяжелой наркотической зависимостью.
Существует несколько способов лазерного воздействия на организм человека: дистанционный, контактный, внутрисосудистый, внутриорганный, внутриполостной, экстракорпоральный [С. Н. Головин, 1994].
В последнее время все большее внимание уделяется методам неинвазивного воздействия лазерным излучением на ткани и организм человека. Это связано как с ростом опасности инфицирования пациентов (ВИЧ-инфекция, вирусный гепатит «В» и пр.), так и со стремлением избежать усложнения процедуры, ликвидировать болезненные и (или) неприятные ощущения, которые, в той или иной степени, неминуемо сопровождают, например, внутривенное лазерное облучение крови (одна из составляющих данной процедуры – введение световода в вену). К тому же, неинвазивные методики значительно снижают санитарно-гигиенические требования к помещениям, в которых проводится лазерное воздействие. Более того, проведение процедур по отдельным неинвазивным методикам и с использованием соответствующего оборудования не требует вообще никаких помещений, т. е. они могут быть реализованы в «полевых условиях» [С. Н. Головин, 1994].
Изначально врачами в их исследовательской и практической работе в основном использовались гелий-неоновые лазеры. Обладая широкими терапевтическими возможностями, эти лазеры, тем не менее, не лишены целого ряда недостатков: малая проникающая способность лазерного излучения красного спектра (1,5–2 см), ограничивающая возможности неинвазивных методов лечения, низкий коэффициент полезного действия (1–2 %) и громоздкость большинства выпускаемых приборов, не позволяющая использовать их вне специально оборудованных кабинетов. Кроме того, работа газовых лазеров требует высоких электрических напряжений, что снижает степень безопасности при их использовании. При работе с гелий-неоновыми лазерными установками медицинский персонал и пациенты обязаны пользоваться специальными защитными очками (СЭС-22–34), обладающими большой оптической плотностью на длине волны генерации лазера, в целях защиты сетчатки глаза от повреждающего действия излучения гелий-неонового лазера. Лазерный свет видимого диапазона вызывает реакции цис-транс-изомеризации сетчатки и способен повредить ее. В ближнем инфракрасном спектре (0,8–1,4 мкм) на предельно допустимом уровне этот эффект отсутствует.
Возросший в последние десятилетия интерес экспериментаторов и клиницистов к полупроводниковым лазерным приборам, генерирующим инфракрасное излучение с длиной волны 0,8–1,4 мкм, обусловлен не только их большей безопасностью (как для врача, так и для больного). Эти лазеры экономичны, портативны, а длина волны их излучения позволяет доставлять энергию лазерного света к тканям и органам человека на глубину до 7 см [М. А. Каплан, В. А. Степанов, О. Ю. Воронина, 1989] (проницаемость тканей для лазерного света зависит в первую очередь от длины волны лазерного излучения – кожные покровы и большинство тканей наиболее проницаемы для излучения с длиной волны 800–1200 нм [А. К. Полонский, 1997; T. Yamamoto, G. Fukumoto, M. Saito, 1981], что позволяет ему при транскутанном воздействии распространяться в ткани на гораздо бо?льшую глубину, чем низкоэнергетическому лазерному излучению с любой другой длиной волны). Глубина проникающей способности лазерного излучения, кроме того, зависит от режима генерации лазерного излучения. В частности, за время лазерного воздействия, равное длительности импульса, ткани, расположенные на максимальной глубине проникновения лазерного луча, при импульсной подаче излучения получают значительно больше энергии, чем при облучении непрерывным низкоэнергетическим лазерным излучением, что объясняется более полной утилизацией атомами и молекулами импульсной энергии [В. Е. Илларионов, 1992]. Более того, есть мнение, что импульсный режим генерации излучения исключает развитие «привыкания» биологических тканей к действию этого физического фактора [С. М. Зубкова, Л. В. Михайлик, В. В. Трушин, И. С. Парфенова, 1994]. И утверждается, что варьируя частоту импульсов в соответствии с оптической плотностью тканей, можно оказать селективное действие на различные биологические структуры [T. I. Karu, 1989; О. Ю. Воронина, М. А. Каплан, В. А. Степанов, 1990; М. Е. Климанов, И. В. Манаев, В. Р. Марлей и др., 1993; S. Rajaratham, P. Bolton, M. Dyson, 1994].
В многочисленных экспериментальных и клинических исследованиях [М. Т. Александров с соавт., 1996; И. М. Байбеков с соавт., 1996; Б. С. Брискин с соавт., 1996; С. П. Гладких с соавт., 1996; С. М. Зубкова, 1991; В. И. Козлов с соавт., 1993; Ю. В. Алексеев, 1999; и др. ] доказано, что использование для лечения большинства патологий низкоэнергетического инфракрасного лазерного излучения в ближнем инфракрасном диапазоне (0,83–1,3 мкм) более эффективно, чем использование с той же целью низкоэнергетического лазерного излучения видимого диапазона.
Полупроводниковые лазеры отвечают таким требованиям современной медицины, как:
– простота управления и контролируемость дозы воздействия на организм;
– портативность, позволяющая работать у постели больного, в машинах скорой помощи, в полевых условиях и т. п.;
– универсальность, возможность сочетания с различными физиотерапевтическими и диагностическими приборами;
– возможность применения лазеротерапии в комплексе с традиционными методами лечения (общего и местного действия);
– широкий диапазон терапевтического воздействия;
– отсутствие при лечении (при следовании методическим рекомендациям) осложнений, побочных явлений, неблагоприятного воздействия;
– узкий круг противопоказаний;
– практическое отсутствие аллергических реакций, а при аллергических состояниях – возможности применения лазеротерапии как монотерапии;
– возможность неинвазивного, бесконтактного применения, что снимает риск заражения СПИДом, вирусным гепатитом «В» и т. д.;
– объективная дозовая зависимость лечебного эффекта;
– абсолютная доступность лазерных терапевтических аппаратов для любого лечебного учреждения.
Требование эффективности неинвазивных методов лазеротерапии обусловило необходимость создания лазерной аппаратуры с определенными рабочими характеристиками (значительная площадь лазерного воздействия, экономичность и автономность питания аппарата, простота управления лазером, портативность). Все эти требования воплотились в портативном матричном терапевтическом магнито-свето-ИК-лазерном аппарате «МИЛТА-спорт» («МИЛТА-Ф-5–01»), являющимся, по нашему мнению, наиболее функциональным и удобным для использования в медицинской практике лазерным терапевтическим аппаратом.
Отмечен феномен «прозрачности» тканей тела для ближнего инфракрасного света – до 7 см на уровне 0,1 % от исходной интенсивности лазерного излучения на поверхности тела [Ю. К. Токмачев с соавт., 1988]. Результаты проведенных исследований свидетельствуют, что излучение с длиной волны 0,89 мкм в среднем в 2–3 раза глубже проникает в ткани, чем излучение с длиной волны 0,63 мкм при одинаковых потерях энергии [А. Ю. Дуплик, 1990]. О перспективности одного из неинвазивных методов – чрескожной лазеротерапии – говорят многие исследователи [С. Б. Баракаев, 1991; С. Б. Баракаев, Ш. К. Сахибов, 1992; Е. А. Козулин с соавт., 1991; и др. ], причем утверждается, что чрескожная лазеротерапия по эффективности не уступает методике внутривенного лазерного облучения крови [В. М. Ворожейкин, Ш. Н. Артыков, 1991; А. К. Полонский, 1992]. О преимуществах чрескожного (транскутанного) лазерного воздействия говорится в работах многих авторов [С. Н. Головин, 1994; С. Е. Павлов, Т. Н. Кузнецова, 1997; и др.].

Рис. 7. Дивергенция лазерного света в тканях
Для чрескожного надсосудистого лазерного воздействия более оправдано применение инфракрасного излучения [В. И. Илларионов, 1994]. Имеются сообщения о малой эффективности красного лазерного света (длина волны – 0,633 мкм) при транскутанном методе его применения [И. П. Василевская с соавт., 1988]. При контактном (транскутанном) способе доставки лазерного излучения к тканям биологического объекта большая часть лазерной энергии поглощается тканями объекта, в которых распространяется по законам нелинейной оптики вследствие их неоднородности, различного соотношения протеинов, жировой ткани, воды и электролитов. Дивергенция лазерного луча (рис. 7) позволяет облучать в несколько раз большие площади глублежащих тканей по сравнению с диаметром лазерного луча на выходе из излучателя [В. И. Корепанов, 1995]. В. И. Корепанов (1995) пишет о принципе полизонального лазерного воздействия. Об эффективности метода полизонального транскутанного лазерного воздействия на кровь сообщается в исследованиях спортивных специалистов, работавших с пловцами [С. Е. Павлов, Т. Н. Кузнецова, 1997].

Рис. 8. Многоплановое действие лазерного света
Таким образом, справедливо говорить о многоплановом (рис. 8) и многоуровневом действии лазерного излучения на биологический объект, ожидая от него (объекта) системных ответов [С. Е. Павлов, Т. Н. Кузнецова, 1997]:
1. На клеточном уровне в результате лазерного воздействия наблюдается изменение заряда электрического поля клетки, изменение мембранного потенциала клетки. На фоне стимуляции функций ядерного аппарата повышается митотическая активность клетки, активируются процессы размножения, а также внутри– и внеклеточной регенерации. Низкоэнергетическое лазерное излучение в используемых параметрах обладает антимутагенной активностью, что является его большим преимуществом по сравнению со многими лечебными средствами.
2. На тканевом уровне в результате лазерного воздействия повышается поглощение тканями кислорода, изменение рН межклеточной жидкости, морфофункциональной активности, значительное расширение микроциркуляторного русла, противоотечное и противовоспалительное действие; анальгезирующий и противозудный эффекты.
3. При воздействии низкоэнергетического лазерного излучения на кровь наблюдается стимуляция фагоцитоза, миграционной активности лейкоцитов, растет содержание эритроцитов в сторону более стойких клеток, стимулируется эритропоэтическая функция костного мозга, повышается кислородная емкость крови, отмечается десенсибилизирующий эффект, снижается вязкость и свертываемость крови, улучшаются ее реологические качества, снижаются: уровень глюкозы, концентрации холестерина, липопротеидов низкой и очень низкой плотности.
4. На органном уровне в результате лазерного воздействия происходит восстановление (нормализация) функций органов.
5. На организменном уровне в результате лазерного воздействия повышается адаптационная устойчивость, стабилизируется нервно-психический статус, отмечается иммуномодулирующий эффект, стабилизируется эндокринный баланс, нормализуется артериальное давление.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК