Глава 8. Митральный клапан
Глава 8. Митральный клапан
Общие вопросы
Нормальные клапаны сердца так тонки и подвижны, что их не удается визуализировать с помощью большинства диагностических методов. Эхокардиография, которая фиксирует различия в акустических характеристиках между соединительной тканью и кровью, позволяет в подробностях рассмотреть клапаны сердца. Для исследования клапанного аппарата сердца применяются все существующие разновидности эхокардиографии.
Преимуществом М-модальной эхокардиографии является высокая разрешающая способность; недостатком — ограниченная зона наблюдения. Основная сфера применения М-модальной эхокардиографии — регистрация тонких движений клапанов, таких, как диастолическая вибрация передней створки митрального клапана при аортальной недостаточности или средне-систолическое прикрытие аортального клапана при гипертрофической кардиомиопатии.
Двумерная эхокардиография обеспечивает большую зону наблюдения, однако чем эта зона больше, тем меньше разрешающая способность метода; важное преимущество двумерной эхокардиографии состоит в том, что эти методом можно определить распространенность поражения клапанного аппарата, например, при склерозировании аортального клапана.
Допплеровская эхокардиография позволяет качественно и количественно оценивать кровоток через каждый из сердечных клапанов. Главный недостаток метода — в необходимости направлять ультразвуковой луч строго по потоку, чтобы избежать искажения результатов исследования. Однако такие открываемые допплер-эхокардиографией возможности как оценка гемодинамической значимости аортального стеноза и вычисление давления в легочной артерии — это почти революционные достижения, которые могут служить образцом того, что может дать неинвазивный метод.
С широким распространением эхокардиографии все большему числу пациентов проводится хирургическая коррекция клапанных пороков сердца без предварительной катетеризации сердца. Можно уверенно положиться на результаты эхокардиографической оценки выраженности порока, приведшего к тяжелым нарушениям гемодинамики. Только в двух случаях эхокардиографического исследования недостаточно: 1) если возникает противоречие между данными клиники и результатами эхокардиографического исследования; 2) если при несомненной необходимости хирургической коррекции порока требуется выяснить другие вопросы, чаще всего — наличие или отсутствие патологии коронарных артерий [87].
Нормальный митральный клапан
Исторически именно митральный клапан был первой структурой, распознанной при ультразвуковом исследовании сердца. Ориентация широкой поверхности передней створки митрального клапана по отношению к грудной клетке делает ее идеальным объектом для отражения ультразвукового сигнала. Передняя створка митрального клапана весьма подвижна, отношение длины ее края к основанию велико: это позволяет хорошо рассмотреть ее структуру и движение как при М-модальном, так и при двумерном исследовании.
Эхокардиография позволяет диагностировать практически любую патологию митрального клапана; в частности, пролапс митрального клапана. Наши знания о широкой распространенности этой патологии в популяции — следствие широкого внедрения эхокардиографии в клиническую практику на протяжении последних 15 лет.
Полноценное эхокардиографическое исследование должно включать М-модальное, двумерное и допплеровское (в импульсном, постоянно-волновом режимах и цветное сканирование) исследования митрального клапана. Допплеровские методы весьма информативны для диагностики патологии митрального клапана и для количественной оценки трансмитрального кровотока. Митральный клапан исследуют из нескольких доступов: парастернального, апикального и, реже, из субкостального.
При М-модальном исследовании видно, что движение нормального митрального клапана отражает все фазы диастолического наполнения левого желудочка (рис. 2.3). Раннее максимальное открытие митрального клапана (движение передней створки в сторону межжелудочковой перегородки) соответствует раннему, пассивному, диастолическому наполнению левого желудочка; второй, меньший, пик соответствует предсердной систоле. Между этими пиками митральный клапан почти закрывается (период диастазиса) вследствие выравнивания давлений в желудочке и предсердии. Во время предсердной систолы клапан открывается вновь, так что форма движения передней створки клапана напоминает букву М, а движение задней створки зеркально отображает движение передней, уступая по амплитуде. Закрытие митрального клапана в конце диастолы происходит в результате замедления притока крови из предсердия и начала изометрического сокращения левого желудочка.
Двумерные изображения митрального клапана зависят от позиции, из которой производится исследование. Так, при парастернальном исследовании по короткой оси митральный клапан виден как структура яйцевидной формы, а при исследовании по длинной оси он напоминает открывающиеся и захлопывающиеся дверцы, передняя из которых больше задней. На рис. 2.1 приведено изображение митрального клапана при исследовании по парастернальной длинной оси левого желудочка, на рис. 2.11 — при исследовании в четырехкамерной позиции из апикального доступа. В целом, нормальный митральный клапан должен выглядеть как подвижная двустворчатая структура, которая открывается настолько, чтобы не препятствовать наполнению желудочка, надежно смыкается в систолу, не проваливаясь при этом в левое предсердие. Нормально закрывающийся митральный клапан движется в систолу вместе с основанием сердца и участвует при накачивании крови в левое предсердие. Другими анатомическими структурами, относящимися к митральному клапану, являются хорды, папиллярные мышцы и левое атриовентрикулярное кольцо.
При допплеровском исследовании нормального митрального клапана обнаруживается, что скорость кровотока через него тоже можно изобразить графически буквой М. Иными словами, кровоток имеет максимальную скорость в раннюю диастолу, затем почти прекращается и вновь ускоряется во время предсердной систолы. Направить ультразвуковой луч параллельно кровотоку через митральный клапан удается чаще всего из апикального доступа, который и используют для допплеровского исследования митрального клапана. В норме максимальная скорость трансмитрального кровотока чуть меньше 1 м/с (рис. 3.4С).
Митральный стеноз
Митральный стеноз был первым заболеванием, распознанным при помощи эхокардиографии. В подавляющем большинстве случаев причина митрального стеноза — ревматизм. Анатомические проявления митрального стеноза заключаются в частичном сращении комиссур между передней и задней створками и изменениях подклапанного аппарата — укорочении хорд. В результате уменьшается площадь митрального отверстия, что приводит к обструкции диастолического кровотока из левого предсердия в желудочек. При митральном стенозе из-за неполного раскрытия клапана меняется траектория его быстрого двухфазного движения. Эхокардиография позволяет не только поставить диагноз митрального стеноза, но и точно рассчитать площадь митрального отверстия, так что пациент может быть направлен на операцию или баллонную вальвулопластику без предварительной катетеризации сердца. Количественную оценку степени тяжести митрального стеноза можно производить тремя эхокардиографическими методами.
1. М-модальное исследование. При М-модальном исследовании пациента с митральным стенозом видны изменения формы движения митрального клапана, выражающиеся в удлинении времени его раннего прикрытия (рис. 8.1). Можно видеть однонаправленное диастолическое движение кончиков створок митрального клапана. Наклон раннего диастолического прикрытия передней створки митрального клапана (сегмент EF М-модального изображения митрального клапана) позволяет распознать митральный стеноз. Наклон сегмента EF менее чем на 10 мм/с (в норме > 60 мм/с) на фоне задержки дыхания свидетельствует о тяжелом митральном стенозе. В настоящее время этот признак практически не используется, так как это наименее надежный из способов определения тяжести митрального стеноза.
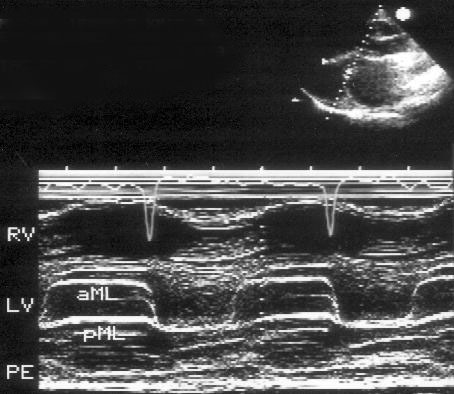
Рисунок 8.1. Критический митральный стеноз, М-модальное исследование: однонаправленное диастолическое движение кончиков створок митрального клапана; наклон диастолического прикрытия передней створки митрального клапана почти отсутствует. RV — правый желудочек, LV — левый желудочек, PE — небольшой выпот в полости перикарда, aML — передняя створка митрального клапана, pML — задняя створка митрального клапана.
2. Двумерное исследование. В норме при исследовании из парастернальной позиции длинной оси левого желудочка передняя створка митрального клапана во время максимального раскрытия клапана в диастолу выглядит продолжением задней стенки аорты, тогда как при митральном стенозе она имеет куполообразное закругление [doming] в сторону задней створки. Кратчайшим расстоянием между клапанами становится расстояние между их кончиками (рис. 8.2). Куполообразное закругление створки возникает из-за увеличения давления на незафиксированную ее часть; аналогией может служить надувание паруса. Площадь митрального отверстия следует измерять в парастернальной позиции короткой оси левого желудочка строго на уровне кончиков створок (рис. 8.3). Этот планиметрический способ оценки тяжести митрального стеноза существенно надежнее М-модального.
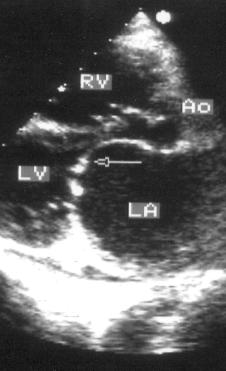
Рисунок 8.2. Митральный стеноз: парастернальная позиция длинной оси левого желудочка, диастола. Куполообразное выбухание передней створки митрального клапана (стрелка). LA — левое предсердие, RV — правый желудочек, LV — левый желудочек, Ao — восходящий отдел аорты.
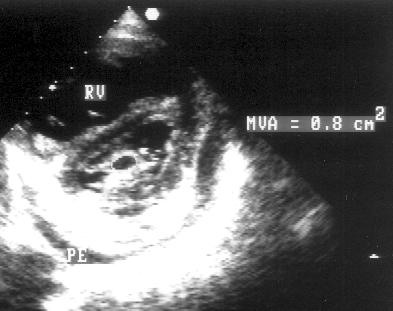
Рисунок 8.3. Митральный стеноз: парастернальная позиция короткой оси левого желудочка на уровне митрального клапана, диастола. Планиметрическое измерение площади митрального отверстия. RV — правый желудочек (расширенный), PE — небольшое количество жидкости в полости перикарда, MVA — площадь митрального отверстия.
3. Допплеровские исследования трансмитрального кровотока (рис. 8.4). При митральном стенозе максимальная скорость раннего трансмитрального кровотока увеличена до 1,6—2,0 м/с (норма — до 1 м/с). По максимальной скорости рассчитывают максимальный диастолический градиент давления между предсердием и желудочком. Для расчета площади митрального отверстия исследуют изменения этого градиента: вычисляют время полуспада градиента давления (T1/2), т. е. время, за которое максимальный градиент снижается вдвое. Поскольку градиент давления пропорционален квадрату скорости кровотока (?P=4V2), время его полуспада эквивалентно времени, за который максимальная скорость снижается в ?2 (ок. 1,4) раз. Работами Hatle было эмпирически установлено, что время полуспада градиента давления, равное 220 мс, соответствует площади митрального отверстия 1 см2 [96]. Измерение площади митрального отверстия (MVA) производится в постоянно-волновом режиме из апикального доступа по формуле: [Площадь отверстия митрального клапана (MVA, см2)] = 220/T1/2.
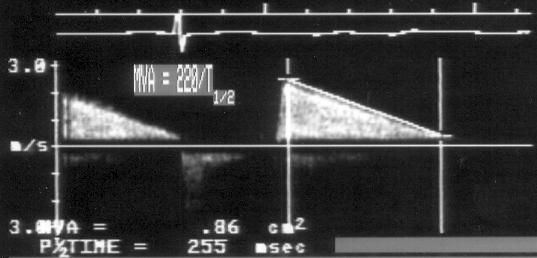
A

B
Рисунок 8.4. Два случая митрального стеноза: критический стеноз (А) и стеноз небольшой степени выраженности (В). Постоянно-волновое допплеровское исследование, апикальный доступ. Измерение площади митрального отверстия основано на вычислении времени полуспада трансмитрального градиента давления. Чем быстрее падает скорость диастолического трансмитрального кровотока при митральном стенозе, тем больше площадь митрального отверстия. MVA — площадь митрального отверстия.
Из всех трех названных методов допплеровский наиболее надежен, и ему следует отдавать предпочтение перед М-модальным и двумерным определением площади митрального отверстия. В табл. 10 приведен перечень измерений, которые необходимо произвести при допплеровском исследовании пациента с митральным стенозом.
Таблица 10. Параметры, определяемые при допплеровском исследовании пациента с митральным стенозом
Позиции и измерения Максимальная скорость и наилучшего качества спектр диастолического кровотока через митральный клапан в 4-камерной позиции из апикального доступа в постоянно-волновом режиме Расчетные параметры 1. Максимальный градиент давления между левым предсердием и желудочком 2. Время полуспада градиента давления (T1/2) 3. Площадь отверстия митрального клапана (MVA, см2) = 220/T1/2Цветное допплеровское сканирование позволяет видеть область ускорения кровотока в месте сужения митрального отверстия (так называемая, vena contracta) и направление диастолических потоков в левом желудочке. Цветное сканирование позволяет точнее определить пространственную ориентацию стенотической струи, что помогает установить ультразвуковой луч параллельно потоку во время постоянно-волнового исследования при эксцентрическом направлении струи.
Нужно помнить, что время полуспада градиента давления зависит не только от площади митрального отверстия, но и от сердечного выброса, давления в левом предсердии, податливости левого желудочка. Использование допплеровского метода измерения площади митрального отверстия может привести к недооценке тяжести митрального стеноза при кардиомиопатии или выраженной аортальной регургитации, так как эти состояния сопровождаются быстрым увеличением диастолического давления левого желудочка и, следовательно, быстрым падением скорости трансмитрального кровотока. Неправильный результат измерения площади митрального отверстия может дать атриовентрикулярная блокада 1-й степени, мерцательная аритмия при высокой частоте сокращений желудочков или выраженной ее вариабельности. Иногда трудно решить, какой комплекс диастолического трансмитрального кровотока взять за основу для вычисления площади митрального отверстия при мерцательной аритмии. Мы рекомендуем использовать комплексы, соответствующие самому большому интервалу RR (равному по крайней мере 1000 мс) на мониторном отведении электрокардиограммы. Еще одним источником ошибок при измерении площади митрального отверстия может быть нелинейность снижения скорости диастолического трансмитрального кровотока (рис. 8.5). В этом случае тоже трудно решить, какую часть допплеровского спектра выбрать для измерений. Hatle [95] рекомендует измерять часть спектра, соответствующую большему времени полуспада градиента давления (и, соответственно, меньшей площади митрального отверстия).

Рисунок 8.5. Митральный стеноз: постоянно-волновое допплеровское исследование из апикального доступа. Нелинейность нисходящей части допплеровского спектра стенотической струи — возможный источник ошибок при допплеровском определении площади митрального отверстия. На рисунке приведены возможные варианты расчета площади митрального отверстия; при катетеризации сердца площадь митрального отверстия оказалась равной 0,7 см2.
Косвенные методы оценки тяжести митрального стеноза включают определение степени укорочения хорд, выраженности кальциноза створок митрального клапана, степени увеличения левого предсердия, изменения объемов левого желудочка (т. е. степени его недонаполнения) и исследование правых отделов сердца. Изучая размеры правых отделов сердца и давление в легочной артерии (по градиенту трикуспидальной регургитации), можно в каждом отдельном случае судить о последствиях митрального стеноза и о риске операции.
Обструкция приносящего тракта левого желудочка неревматической этиологии
Кальциноз митрального кольца [104, 108] — частая эхокардиографическая находка. Это — дегенеративный процесс, чаще всего связанный с преклонным возрастом пациента. Нередко кальциноз митрального кольца обнаруживают при гипертрофической кардиомиопатии, при болезнях почек. Кальциноз митрального кольца может стать причиной нарушения атриовентрикулярной проводимости [109]. Обычно кальциноз митрального кольца не сопровождающаяся гемодинамически значимой митральной недостаточностью или стенозом (рис. 8.6), но в редких случаях инфильтрация кальцием всего аппарата митрального клапана выражены настолько, что приводят к обструкции митрального отверстия, требующей хирургического вмешательства. Допплеровское измерение площади митрального отверстия — лучший способ выявить и оценить тяжесть этого редкого осложнения частой патологии.
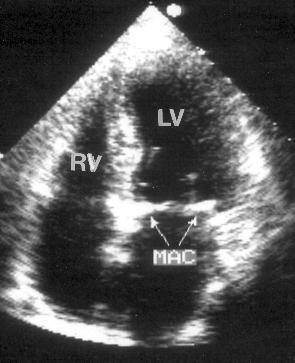
Рисунок 8.6. Кальциноз митрального кольца: апикальная позиция четырехкамерного сердца. RV — правый желудочек, LV — левый желудочек, MAC — кальциноз митрального отверстия.
Врожденные пороки, сопровождающиеся обструкцией приносящего тракта левого желудочка, редко встречаются у взрослых. К этим порокам относятся парашютный митральный клапан (единственная папиллярная мышца), надклапанное митральное кольцо и трехпредсердное сердце [cor triatriatum] (рис. 8.7). Нормальному наполнению левого желудочка может препятствовать миксома левого предсердия. Карциноидный синдром [carcinoid] может развиться у больных с метаболически активными серотонин-продуцирующими опухолями. Это редкий синдром, и при нем чаще всего обнаруживается изолированное поражение правых отделов сердца сердца (рис. 10.3). Из 18 случаев этого заболевания, наблюдавшихся в Лаборатории эхокардиографии UCSF, только в двух отмечалась патология левых отделов сердца, связанная, предположительно, с бронхогенным раком.
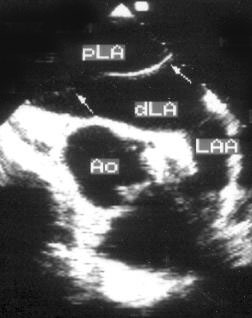
Рисунок 8.7. Cor triatriatum (трехпредсердное сердце): мембрана, разделяющая левое предсердие на проксимальную и дистальную камеры. Чреспищеводное эхокардиографическое исследование в поперечной плоскости на уровне основания сердца. Ao — восходящий отдел аорты, LAA — ушко левого предсердия, dLA — дистальная камера левого предсердия, pLA — проксимальная камера левого предсердия.
Митральная недостаточность
Стенозирующие поражения митрального клапана изменяют его диастолическое движение и легко могут быть распознаны с помощью М-модальной и двумерной эхокардиографии. Патология митрального клапана, сопровождающаяся митральной недостаточностью, часто малозаметна, и диагностировать ее сложнее. Это происходит потому, что движения митрального клапана в систолу минимальны, но если даже малая часть клапана функционирует неправильно, то возникает выраженная митральная регургитация. Тем не менее в большом количестве случаев митральной недостаточности все-таки можно выявить ее анатомические причины с помощью эхокардиографии.
Данные, приведенные в табл. 11, дают представление об основных этиологических причинах митральной регургитации. Эта таблица основана на результатах проводившейся в 1976—81 гг. работы, в которой исследовались данные эхокардиографии, ангиографии и оперативного лечения у 173 больных с митральной регургитацией [88]. Заметим, что пролапс митрального клапана оказался ведущей причиной митральной регургитации.
Таблица 11. Этиология митральной регургитации
Число случаев Доля от общего числа, % Пролапс митрального клапана 56 32,3 Ревматизм 40 23,1 Заболевания миокарда (дилатация ЛЖ — 11%, гипертрофия — 6%) 30 17,3 Ишемическая болезнь сердца 27 15,6 Бактериальный эндокардит 11 6,3 Врожденные пороки сердца 9 5,2 По материалам Delaye J, Beaune J, Gayet JL et al. Current etiology of organic mitral insufficiency in adults. Arch Mal Coeur 76:1072,1983Допплеровское исследование играет очень важную роль в диагностике митральной недостаточности любой степени выраженности. Лучший метод поиска митральной регургитации — цветное допплеровское сканирование [81, 83, 97], так как оно обладает высокой чувствительностью, и его проведение не требует много времени. Цветное допплеровское сканирование дает информацию о митральной регургитации в реальном масштабе времени. Хотя представление о направлении и глубине проникновении регургитирующей струи может быть получено и в импульсном допплеровском режиме, цветное сканирование надежнее и технически проще, особенно при эксцентрической регургитации. Из апикального доступа митральная регургитация выглядит как появляющееся в систолу пламя светло-синего цвета, направленное в сторону левого предсердия (рис. 17.9). Для регистрации митральной недостаточности и определения степени ее выраженности метод цветного сканирования по чувствительности приближается к рентгеноконтрастной вентрикулографии.
Около 40—60% здоровых людей имеют митральную регургитацию, причиной которой является недостаточность задне-медиальной комиссуры митрального клапана, но это регургитация выраженная незначительно. Регургитирующая струя при этом проникает в полость левого предсердия менее чем на 2 см. Если поток проникает в полость левого предсердия более чем на половину его длины, достигает его задней стенки, заходит в ушко левого предсердия или в легочные вены, то это указывает на тяжелую митральную недостаточность. На рис. 17.9, 17.10, 17.11 представлена митральная регургитация небольшой, средней и высокой степени выраженности.
Следует иметь в виду, что при исследовании дилатированного левого предсердия происходит потеря чувствительности цветного сканирования на большой глубине, и можно недооценить выраженность митральной регургитации. Ширина формирующейся струи на уровне клапана и расхождение ее на предсердной стороне клапана также позволяют судить о степени митральной регургитации.
Как правило, если с помощью цветного сканирования митральная регургитация не обнаружена, то другие допплеровские методы для ее поисков уже не применяются. Однако при плохой визуализации сердца и цветное сканирование может оказаться недостаточно чувствительным. В случаях, когда трансторакальная эхокардиография технически трудна, а точное знание степени митральной регургитации необходимо, показано проведение чреспищеводной эхокардиографии. К обстоятельствам, затрудняющим оценку степени митральной регургитации при трансторакальном исследовании нужно отнести кальциноз митрального кольца и створок митрального клапана, а также наличие механического протеза в митральной позиции.
На рис. 17.2 представлено изображение незначительно выраженной митральной регургитации, полученное при чреспищеводном цветном допплеровском исследовании пациента с дилатированным левым предсердием. Заметим, что выбор правильного усиления привел к четкой визуализации «спонтанного контрастирования» левого предсердия, что свидетельствует о технически правильном проведении исследования и исключает недооценку степени митральной регургитации. На рис. 17.13 представлена незначительная митральная регургитация, типичная для нормально функционирующего протезированного митрального клапана. Рис. 17.14 иллюстрирует околоклапанную регургитацию высокой степени при дисковом протезе в митральной позиции. На рис. 17.15 видно, как струя митральной регургитации заходит в гигантских размеров ушко левого предсердия.
При невозможности проведения цветного сканирования степень митральной регургитации определяют с помощью допплеровского исследования в импульсном режиме. Контрольный объем сначала устанавливают над местом смыкания створок митрального клапана в левое предсердие. Мы рекомендуем проводить поиск митральной регургитации в нескольких позициях, так как она может иметь эксцентрическое направление. Тщательное допплеровское исследование с помощью современной чувствительной аппаратуры часто выявляет ранние систолические сигналы низкой интенсивности, которые соответствуют так называемой «функциональной» митральной регургитации. Низкая плотность допплеровского спектра при обнаружении такой регургитации говорит о малом числе эритроцитов, в ней участвующих. Возможно, обнаружение такой незначительной регургитации связано с регистрацией движения небольшого количества эритроцитов, остающихся в конце диастолы в преддверии митрального отверстия.
При гемодинамически значимой митральной регургитации интенсивность допплеровского спектра существенно выше. Однако из-за высокой скорости струи митральной регургитации, обусловленной большим градиентом давления в систолу между желудочком и предсердием, при импульсном допплеровском исследовании и при цветном сканировании возникает искажение допплеровского спектра. Чем больше объем регургитирующей крови, тем плотнее допплеровский спектр. Картирование допплеровского сигнала в импульсном режиме состоит в отслеживании регургитирующей струи, начиная от места смыкания створок митрального клапана и далее при перемещении контрольного объема в сторону верхней и боковой стенок левого предсердия. Этот метод определения степени митральной регургитации используют в тех случаях, когда нельзя провести цветное сканирование. Чем плотнее спектр митральной регургитации и чем глубже в левое предсердие она проникает, тем она тяжелее. С помощью постоянно-волнового исследования можно аккуратно измерить максимальную скорость митральной регургитации. Однако этот параметр мало существен для оценки степени выраженности митральной регургитации, поскольку максимальная скорость отражает большой систолический градиент давления между левым желудочком и предсердием, а он велик и в норме, и при патологии. Только при очень тяжелой митральной регургитации давление в левом предсердии в систолу достигает такой величины, что максимальная скорость регургитации уменьшается.
Для оценки степени тяжести митральной недостаточности можно применять двумерные и допплеровские методы вычисления объема регургитирующей крови. При митральной недостаточности объем крови, который поступает из левого желудочка в аорту, меньше объема, поступающего в желудочек в диастолу. Разность между значениями ударного объема, вычисленными планиметрическим (конечно-диастолический минус конечно-систолический объем) и допплеровским (произведение линейного интеграла скорости кровотока в выносящем тракте левого желудочка и площади выносящего тракта) способами, равна объему регургитирующей крови за каждый сердечный цикл. Однако эти вычисления дают большую ошибку, поскольку планиметрические измерения занижают, а допплеровские — завышают значения ударного объема.
Формула расчета фракции регургитирующего объема для оценки тяжести митральной недостаточности применяется редко в связи с высокой вероятностью ошибок. Мы все-таки считаем нужным привести способ расчета фракции регургитирующего объема (табл. 12). Заметим, что условием применимости приведенной формулы является отсутствие патологии аортального клапана.
Таблица 12. Расчет фракции регургитирующего объема (RF) при митральной недостаточности
Позиции и измерения 1. Апикальная 2-камерная позиция 2. Апикальная 4-камерная позиция 3. Раскрытие аортального клапана в М-модальном режиме парастернально 4. Аортальный кровоток из апикального доступа в постоянно-волновом режиме Расчетные параметры 1. Площадь отверстия аортального клапана (AVA) — по диаметру его раскрытия 2. Фракция регургитирующего объема (RF): а) Ударный объем (SVp) по Simpson б) Допплеровское вычисление ударного объема (SVd): SVd = AVA ? VTI, где VTI — интеграл линейной скорости кровотока через аортальный клапан в) RF = (SVp – SVd)/SVpКосвенными показателями степени тяжести митральной недостаточности могут служить размеры левого предсердия и желудочка. Выраженная митральная недостаточность сопровождается дилатацией левого желудочка из-за его объемной перегрузки. Кроме того, повышается давление в легочной артерии, которое можно оценить, измерив скорость струи трикуспидальной регургитации.
Ревматическое поражение митрального клапана, как правило, выражается в сочетанном его поражении. При этом, несмотря на наличие анатомических признаков ревматического митрального стеноза, гемодинамически значимой обструкции приносящего тракта левого желудочка часто не обнаруживается. При эхокардиографическом исследовании в М-модальном и двумерном режиме даже в отсутствии изменений гемодинамики выявляются признаки ревматического поражения в виде утолщения и склерозирования створок, диастолического куполообразного закругления передней створки митрального клапана. В дифференциальной диагностике сочетанного поражения митрального клапана и «чистой» митральной недостаточности главную роль играет допплеровское исследование.
Пролапс митрального клапана был впервые описан как синдром, включающий клинические, аускультативные и электрокардиографические изменения, в середине 60-х годов. Тогда было показано, что средне-систолический щелчок и шум коррелируют с выявляющимся при ангиографии провисанием створок митрального клапана. Осознание важности этого синдрома произошло в начале 70-х годов, когда оказалось, что пролапс митрального клапана имеет яркие эхокардиографические проявления. И именно благодаря эхокардиографии стало ясно, насколько этот синдром распространен в популяции [114, 115]. Наибольшее значение в его диагностике имеет двумерная эхокардиография; допплеровские исследования дополняют ее, позволяя обнаружить позднюю систолическую митральную регургитацию и определить степень ее выраженности.
М-модальная эхокардиография дает около 40% ложно-отрицательных результатов, если за стандарт диагностики берется аускультация сердца. Возможно, такая низкая чувствительность метода связана с деформациями грудной клетки; показано, что до 75% пациентов с пролапсом митрального клапана имеют рентгенологические признаки костных деформаций грудной клетки. Такие деформации (например, pectus excavatum) могут сильно затруднить проведение М-модального исследования. Впрочем, гораздо важнее не помехи для эхокардиографии, а то, что скелетные изменения указывают на системный характер поражения соединительной ткани при пролапсе митрального клапана.
Диагностика пролапса митрального клапана требует обязательного сочетания М-модальной и двумерной эхокардиографии (рис. 8.8, 8.9). Двумерное исследование позволяет рассмотреть створки митрального клапана целиком и найти место их смыкания. Очевидное провисание клапанов в левое предсердие не создает диагностических проблем. Если же створки (или одна створка) доходят только до атриовентрикулярного бугорка, а не далее, это может вызвать диагностические трудности.
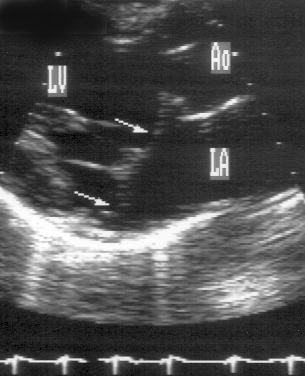
Рисунок 8.8. Пролапс митрального клапана: парастернальная позиция длинной оси левого желудочка, систола. Пролабируют обе створки митрального клапана (стрелки). Хорошо видно, что передняя створка имеет излишнюю, не соответствующую размерам желудочка, длину. LA — левое предсердие, LV — левый желудочек, Ao — восходящий отдел аорты.
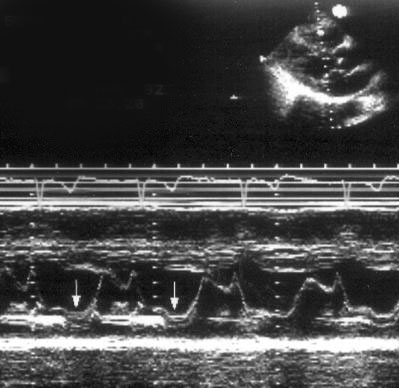
Рисунок 8.9. Поздне-систолический пролапс передней створки митрального клапана, М — модальное исследование. Пролабирование передней створки митрального клапана происходит в конце систолы (стрелки).
Ряд исследователей считают, что поскольку митральное кольцо имеет седловидную форму, и верхние точки его расположены спереди и сзади, то смещение створки выше уровня митрального кольца должно регистрироваться только из тех позиций, которые пересекают клапан в переднезаднем направлении [105]. Такими позициями являются парастернальная длинная ось левого желудочка и апикальная двухкамерная позиция. Было обнаружено, что добавление допплеровского исследования к М-модальному и двумерному дает специфичность диагностики пролапса митрального клапана равную 93%. Представляется, однако, что, диагностику пролапса митрального клапана нельзя основывать на допплеровском исследовании. Учитывая распространенность незначительной митральной регургитации, это может привести к гипердиагностике пролапса митрального клапана. По нашему мнению, диагностически важным результатом допплеровского исследования для распознавания пролапса митрального клапана может считаться только обнаружение поздней систолической митральной регургитации.
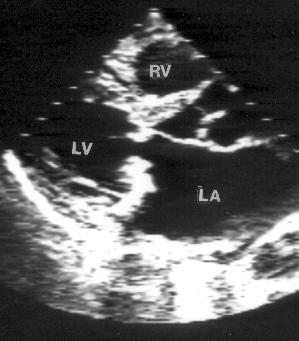
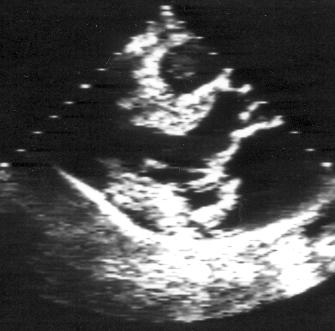
Кроме изменений траектории движения створок, пролапс митрального клапана сопровождается также их утолщением и деформацией. Обычно кончики створок поражены в наибольшей степени и похожи на головку булавки с матовой поверхностью. Утолщение створок иногда распространяется и на хорды. Такие изменения клапанного аппарата называются его миксоматозным перерождением (дегенерацией). Чем сильнее деформирован клапан, тем выше шансы обнаружить утолщение эндокарда межжелудочковой перегородки в том месте, где он соприкасается с чрезмерно подвижной передней створкой (аналогичное локальное утолщение эндокарда межжелудочковой перегородки часто обнаруживают и при гипертрофической кардиомиопатии). Чем сильнее деформированы створки, тем выше вероятность клинических проявлений и осложнений пролапса митрального клапана: болей в грудной клетке, нарушений ритма сердца, бактериального эндокардита, эмболий и разрыва хорд. В предельных случаях часто невозможно отличить пролапс от молотящей створки и массивных вегетаций на митральном клапане (рис. 8.10).
A
B
Рисунок 8.10. Миксоматозная дегенерация митрального клапана, осложнившаяся разрывом хорд и молотящей задней створкой митрального клапана. Парастернальная позиция длинной оси левого желудочка, диастола (А) и систола (В). RV — правый желудочек, LV — левый желудочек, LA — левое предсердие.
Бактериальный эндокардит стали существенно лучше диагностировать с появлением эхокардиографии; расширился диапазон сведений об этой болезни. Прямым и главным признаком бактериального эндокардита при поражении любого клапана служит обнаружение вегетаций. Нарушая целостность створок или хорд, вегетации препятствуют полному закрытию клапана и приводят к митральной недостаточности. Вегетации выглядят как образования на клапанах, обычно весьма подвижные. Обнаружение образований на клапанах при наличии клинических подозрений на бактериальный эндокардит почти всегда позволяет верно поставить диагноз. За свежие вегетации можно, однако, принять и миксоматозную дегенерацию митрального клапана, и старые, «зажившие», вегетации, и разорванную створку или хорду. С другой стороны, если эхокардиографическое исследование проводят вскоре после появления первых клинических симптомов бактериального эндокардита, вегетации можно и не обнаружить. Вегетации небольших размеров могут остаться невыявленными при эхокардиографическом исследовании из-за недостаточной разрешающей способности аппарата, низкого отношения сигнала к шуму либо из-за недостаточной квалификацией или невнимания эхокардиографиста. В Лаборатории эхокардиографии UCSF распознать вегетации диаметром менее 5 мм при М-модальном исследовании почти никогда не удавалось. Двумерное исследование в таких случаях обычно выявляло некоторые изменения створок, но не вегетации. В то же время М-модальное исследование больных с подозрением на бактериальный эндокардит имеет то преимущество перед двумерным исследованием, что позволяет обнаружить нарушение целостности клапана, поскольку регистрирует высокочастотные систолические вибрации, невидимые при двумерном исследовании из-за меньшей временной разрешающей способности.
Нужно иметь в виду, что бактериальный эндокардит обычно поражает исходно измененные клапаны; поэтому распознать вегетации малых размеров (менее 5 мм) на фоне имеющихся изменений клапана почти невозможно. Хорошим примером возможных диагностических трудностей может служить миксоматозная дегенерация митрального клапана с разрывом хорд (рис. 8.10). В этом случае обнаруживается большое, подвижное, пролабирующее, некальцинированное образование, дающее систолическую вибрацию. Диагностику при подобных эхокардиографических находках следует основывать на клинической картине и бактериологических исследованиях крови.
Самый надежный метод выявления вегетаций — чреспищеводная эхокардиография (рис. 16.16). Ее чувствительность при клинически подтвержденном бактериальном эндокардите превышает 90%. Мы рекомендуем проведение чреспищеводной эхокардиографии во всех случаях, когда вегетации не выявлены при трансторакальном исследовании, но имеются подозрения на наличие у пациента бактериального эндокардита.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
19. Митральный стеноз
19. Митральный стеноз Наиболее частой причиной порока является перенесенный ревматизм. Сущностью этого порока является сужение левого предсердно-желудочкового отверстия. В результате этого кровь, которая во время систолы предсердий в норме полностью поступает в левый
ЛЕКЦИЯ № 10. Митральный стеноз
ЛЕКЦИЯ № 10. Митральный стеноз Митральный стеноз – порок сердца, обусловленный сужением левого атриовентрикулярного отверстия, при котором создаются препятствия движению крови из левого предсердия в левый желудочек. Чаще болеют женщины.Этиология. Причинами развития
ЛЕКЦИЯ № 10. Заболевания и пороки сердечно-сосудистой системы: ревматическая болезнь, недостаточность митрального клапана, митральный стеноз
ЛЕКЦИЯ № 10. Заболевания и пороки сердечно-сосудистой системы: ревматическая болезнь, недостаточность митрального клапана, митральный стеноз 1. Ревматическая болезнь сердца, острая ревматическая лихорадка Ревматическая болезнь сердца, или острая ревматическая
3. Митральный стеноз
3. Митральный стеноз Наиболее частой причиной порока является перенесенный ревматизм. Сущностью этого порока является сужение левого предсердно-желудочкового отверстия. В результате этого кровь, которая во время систолы предсердий в норме полностью поступает в левый
Глава 9. Аортальный клапан и корень аорты
Глава 9. Аортальный клапан и корень аорты Исследование аортального клапана стало сильной стороной эхокардиографии со времени ее внедрения в клиническую практику в начале 70-х годов. Поначалу была показана надежность М-модальной эхокардиографии для исключения
Глава 10. Трехстворчатый клапан
Глава 10. Трехстворчатый клапан Эхокардиографическое изучение трехстворчатого клапана, технически более трудное, чем исследование митрального клапана, позволяет обнаружить как первичные его поражения, так и изменения, связанные с другой патологией сердца. Поэтому оно
Глава 11. Клапан легочной артерии
Глава 11. Клапан легочной артерии Легочная артерия и ее клапан визуализируются из нескольких эхокардиографических позиций. Лучше всего эти структуры видны при исследовании из парастернального доступа (рис. 2.6, 2.8). Иногда легочную артерию и ее клапан можно
Глава 6
Глава 6 Питание. – Неурожаи. – Цены на хлеб 1. Факторами, значительно ослабляющими и даже уничтожающими влияние климата на преступления, являются плотность населения и условия питания его.Сопоставляя, по Эттингену, преступления в Пруссии с колебаниями цен на предметы
Митральный стеноз
Митральный стеноз Митральный стеноз – это сужение левого предсердно-желудочкового отверстия. Заболевание может возникать после перенесенного ревматического эндокардита, но не обязательно: у 35 % больных им в анамнезе нет указаний на перенесение ревматизма. Сам по себе
Митральный стеноз
Митральный стеноз Митральный стеноз — это сужение отверстия между левым предсердием и левым желудочком вследствие изменений митрального клапана. Практически все случаи являются следствием ревматизма. Болезнь начинается в молодом возрасте, чаще наблюдается у
Глава 13
Глава 13 Тело, полученное живым существом от материальной природы, определяет уровень его сознания; степень развития сознания определяет характер его деятельности, а чистота этой деятельности определяет его способности постичь Верховного Господа, пребывающего в сердце
Глава о неприличных словах Глава 3
Глава о неприличных словах Глава 3 Вы можете заинтересоваться, почему глава о неприличных словах расположена в самом начале этой замечательной в остальном книги. Наверное, в этой главе есть нечто больше, чем просто неприличные слова. Эта глава, так же как и другие в этой
Митральный стеноз
Митральный стеноз Кровохарканье возникает иногда у животных с митральным стенозом. Причиной кровохарканья при митральном стенозе являются застойные явления в малом кругу кровообращения, а также его осложнение – инфаркт легкого. Для митрального стеноза характерны