Глава 16. Чреспищеводная эхокардиография
Глава 16. Чреспищеводная эхокардиография
Трансторакальная эхокардиография, безусловно, достигла больших успехов. Однако в ряде случаев ее проведению мешают акустические препятствия на пути ультразвукового луча, которые локализуются вне сердца (ребра, легкие, мышцы, подкожно-жировая клетчатка) или в самом сердце (протезированные клапаны, кальциноз). Кроме того, при трансторакальном исследовании взрослых для достижения нужной проникающей способности ультразвука приходится применять датчики с частотой 2,5—3,5 МГц, что ограничивает разрешающую способность метода. Использование чреспищеводного ультразвукового доступа позволяет преодолеть все эти трудности: пищевод непосредственно прилежит к левому предсердию (расположенному кпереди от пищевода) и нисходящему отделу аорты (расположенному кзади от пищевода). Поэтому чреспищеводная эхокардиография получает все большее клиническое применение для распознавания опухолей и тромбов в предсердиях, патологии протезированных клапанов, бактериального эндокардита, болезней аорты, врожденных пороков сердца, а также для интраоперационного мониторинга функции левого желудочка. Разумеется, чреспищеводное исследование не так легко выполнимо технически, как трансторакальное; чреспищеводное исследование имеет уже полуинвазивный характер. Поэтому его проведению всегда должно предшествовать тщательное трансторакальное исследование.
Оборудование
Первый чреспищеводный датчик был разработан Frazin с соавт. в 1976 году и позволял проводить только М-модальное исследование. Современное оборудование позволяет исследовать сердце в двумерном режиме, импульсном и (с недавнего времени) постоянно-волновом допплеровском режиме, а также проводить цветное сканирование; сейчас на смену одноплоскостному [monoplane] датчику приходят двухплоскостные [biplane]. Оборудование, необходимое для проведения чреспищеводной эхокардиографии, включает стандартный эхокардиограф (с программным обеспечением для чреспищеводного исследования), эндоскоп (без световой оптики) и прикрепленный к нему ультразвуковой датчик (датчики). Датчики генерируют ультразвук частотой 5,0—7,5 МГц. Толщина стандартного эндоскопа вместе с датчиком — 9—11 мм, длина 60—100 см, датчик содержит 48—64 кристаллических элемента (появляются датчики со 128 кристаллическими элементами). На поверхность эндоскопа нанесены отметки, позволяющие определять глубину, на которую введен датчик. С помощью двух ручек управления можно поворачивать конец эндоскопа вправо-влево (внешняя ручка) и сгибать-разгибать его (внутренняя ручка) для оптимальной визуализации отдельных структур сердца. Угол сканирования датчика — 90°. Двухплоскостные датчики позволяют производить исследование в горизонтальной и сагитальной плоскостях, но их датчики содержат вдвое меньшее число кристаллических элементов, что несколько ухудшает разрешающую способность. Большинство эндоскопов снабжены дополнительно термочувствительными датчиками для защиты пищевода от повреждения; при повышении температуры в пищеводе выше 42°С они автоматически отключаются (это иногда создает помехи при исследовании лихорадящих больных). Кроме того, большинство эндоскопов имеют ограниченные возможности сгибания-разгибания.
Техника проведения исследования
Подготовка к исследованию. Относительными противопоказаниями к исследованию являются заболевания пищевода: злокачественные новообразования, дивертикул пищевода, фистулы, стриктуры, варикозное расширение вен пищевода, эзофагит при системной склеродермии, кровотечение из верхней части желудочно-кишечного тракта. В течение 4—6 часов перед исследованием пациент должен голодать. Съемные зубные протезы и назогастральные зонды для кормления должны быть удалены. Следует установить катетер в периферическую вену. Наготове должно быть оборудование для ингаляции кислорода, удаления слюны, измерения артериального давления и стандартный реанимационный набор. Мониторное отведение электрокардиограммы регистрируется на протяжении всего исследования.
Профилактика бактериального эндокардита. В разных лабораториях этот вопрос решается по-разному. Эндоскопические процедуры не сопровождаются бактериемией, если не производится биопсия. Тем не менее, некоторые исследователи рекомендуют внутривенное назначение антибиотиков пациентам, имеющим высокий риск развития бактериального эндокардита (например, при протезированных клапанах сердца или комбинированных врожденных пороках сердца). Американская кардиологическая ассоциация относит чреспищеводную эхокардиографию к числу процедур, связанных с низким риском бактериального эндокардита и не требующих его профилактики. По-видимому, можно ограничиться назначением пероральных антибиотиков широкого спектра действия в случаях высокого риска бактериального эндокардита.
Премедикация. Перед исследованием внутривенно вводят транквилизаторы (например, диазепам от 2 до 5 мг) и иногда наркотические анальгетики: последние улучшают переносимость процедуры, но потенциально опасны при заболеваниях легких, и потому их следует назначать с осторожностью. Также с осторожностью нужно назначать антихолинергические препараты (атропин 0,2—0,5 мг внутривенно) для уменьшения секреции слюны.
Интубация пищевода. Для уменьшения рвотного рефлекса производят поверхностную анестезию глотки (аэрозоль лидокаина 10%). Следует помнить о том, что избыточное количество лидокаина может провоцировать желудочковые аритмии. При интубации пищевода пациента лежит на левом боку. Датчики на конце эндоскопа смазывают гелем для ультразвуковых исследований. Во избежание повреждения эндоскопа зубами, на него надевают загубник. Двумя пальцами левой руки врач придерживает язык пациента, правой рукой медленно продвигает эндоскоп в глотку до появления препятствия на его пути (приблизительно на глубине 10 см). Затем пациент должен сделать глоток, и эндоскоп почти беспрепятственно вводится в пищевод. В случаях, когда возникают затруднения с интубацией пищевода, в процедуре должен участвовать анестезиолог.
Общее время нахождения эндоскопа в пищеводе обычно не превышает 15—20 минут. Все исследование должно регистрироваться на видеопленку от начала до конца. Усиление ультразвукового сигнала устанавливают таким образом, чтобы в полостях сердца были в небольшом количестве видны артефакты. Нельзя поддаваться искушению получать более «красивые» изображения и устанавливать слишком низкий уровень усиления: при этом можно пропустить, например, эффект «псевдоконтрастирования» (рис. 17.12) или не определить истинные границы эндокарда.
Осложнения. При гастроскопии вероятность перфорации пищевода считается равной 1:3000. При чреспищеводной эхокардиографии она еще меньше, так как исследованию не подвергают пациентов с какой-либо патологией пищевода. К другим осложнениям чреспищеводной эхокардиографии относятся: предсердные и желудочковые нарушения ритма сердца, вагусные сосудистые реакции, гипоксемия. При назначении седативных препаратов не исключена их индивидуальная непереносимость.
Эхокардиографические позиции
Чреспищеводное эхокардиографическое исследование начинается с введения эндоскопа с обращенным кпереди датчиком в пищевод на глубину 25—30 см от края зубов. В результате датчик оказывается позади левого предсердия. Смена эхокардиографических позиций производится путем незначительных изменений глубины введения датчика (при исследовании в горизонтальной плоскости) и вращения его влево-вправо (при исследовании в вертикальной плоскости). Сканирование в горизонтальной (поперечной) плоскости проводят из следующих позиций [228, 230, 232, 245—247]:
1. Поперечная короткая ось на уровне основания сердца (рис. 16.1). В этой позиции видны створки аортального клапана, корень аорты, проксимальная часть восходящей аорты, верхняя полая вена, проксимальная часть ствола легочной артерии, ушко левого предсердия, легочные вены и проксимальные сегменты коронарных артерий.

Рисунок 16.1. Чреспищеводное эхокардиографическое исследование в поперечной плоскости: поперечная короткая ось на уровне основания сердца. LA — левое предсердие, L — левая коронарная створка аортального клапана, R — правая коронарная створка аортального клапана, N — некоронарная створка аортального клапана, RA — правое предсердие, PA — ствол легочной артерии, RV — правый желудочек.
2. Продвижение эндоскопа на 1—2 см позволяет визуализировать выносящий тракт левого желудочка (рис. 16.2) по длинной оси, левое предсердие, левый желудочек и митральный клапан.

Рисунок 16.2. Чреспищеводное эхокардиографическое исследование в поперечной плоскости: позиция длинной оси выносящего тракта левого желудочка. LA — левое предсердие, LV — левый желудочек, RV — правый желудочек, RA — правое предсердие, LVOT — выносящий тракт левого желудочка.
3. Разгибание конца эндоскопа (отклонение датчика кзади) позволяет получить 4-камерную позицию (рис. 16.3): правый и левый желудочки, правое и левое предсердия, межжелудочковую и межпредсердную перегородки, митральный и трехстворчатый клапаны.
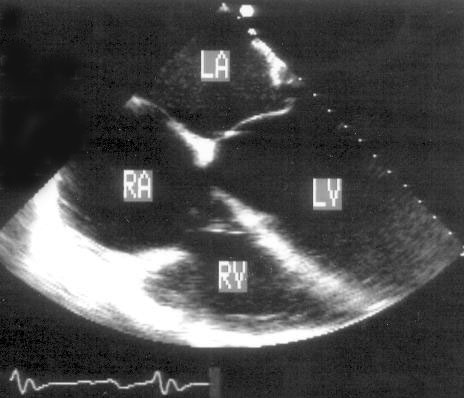
Рисунок 16.3. Чреспищеводное эхокардиографическое исследование в поперечной плоскости: позиция четырехкамерного сердца. Эта позиция напоминает перевернутую апикальную позицию четырехкамерного сердца. LA — левое предсердие, LV — левый желудочек, RA — правое предсердие, RV — правый желудочек.
4. Продвинув эндоскоп глубже, в желудок, можно получить трансгастральную короткую ось левого желудочка (рис. 16.4).
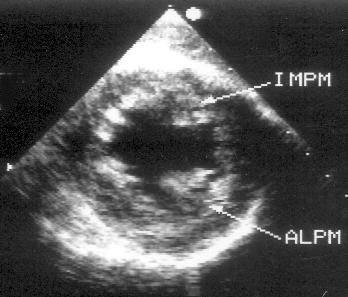
Рисунок 16.4. Чреспищеводное эхокардиографическое исследование в поперечной плоскости: трансгастральная короткая ось левого желудочка. Из этой позиции производится интраоперационный мониторинг локальной и глобальной сократимости левого желудочка. Ближайшая к датчику стенка левого желудочка — задняя, слева на изображении — межжелудочковая перегородка, внизу — передняя стенка левого желудочка, справа — боковая стенка левого желудочка. IMPM — задне-медиальная папиллярная мышца, ALPM — передне-латеральная папиллярная мышца.
5. Поворот эндоскопа на 180°. позволяет визуализировать, по мере извлечения эндоскопа, нисходящий отдел аорты, дугу аорты, восходящий отдел аорты (рис. 16.5) в их поперечном сечении. Левая главная и промежуточная ветви бронхов нередко закрывают часть восходящего отдела аорты и ствол легочной артерии.
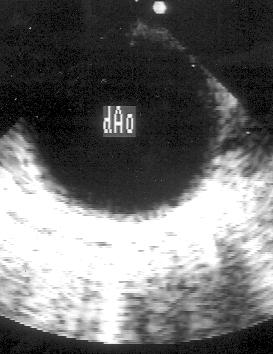
Рисунок 16.5. Чреспищеводное эхокардиографическое исследование в поперечной плоскости: нисходящий отдел аорты (dAo) в его поперечном сечении.
Применение двухплоскостного датчика позволяет получать сечения сердца в вертикальной (сагитальной) плоскости. Это дает возможность исследовать сердце из следующих позиций:
1. Вертикальная короткая ось на уровне основания сердца (рис. 16.6): видны правое и левое предсердия, нижняя и верхняя полые вены.
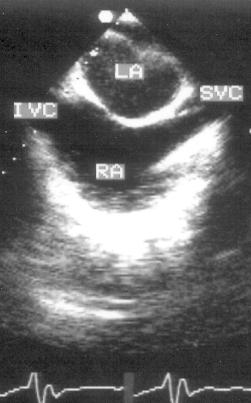
Рисунок 16.6. Чреспищеводное эхокардиографическое исследование в вертикальной плоскости: вертикальная короткая ось на уровне основания сердца. LA — левое предсердие, RA — правое предсердие, IVC — нижняя полая вена, SVC — верхняя полая вена.
2. Двухкамерная позиция из наддиафрагмального доступа (рис. 16.7): видны левый желудочек и левое предсердие, верхняя правая и верхняя левая легочные вены.

Рисунок 16.7. Чреспищеводное эхокардиографическое исследование в вертикальной плоскости: вертикальная двухкамерная позиция. LA — левое предсердие, LV — левый желудочек.
3. Трансгастральная длинная ось левого желудочка (рис. 16.8): видны левое предсердие и левый желудочек с «усеченной» верхушкой.
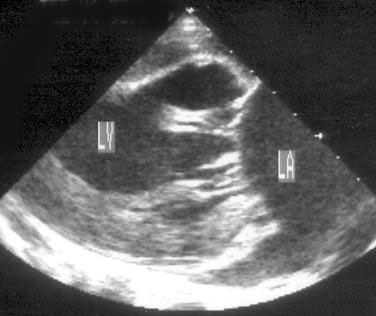
Рисунок 16.8. Чреспищеводное эхокардиографическое исследование в вертикальной плоскости: трансгастральная длинная ось левого желудочка. LA — левое предсердие, LV — левый желудочек.
Амбулаторная чреспищеводная эхокардиография
Протезированные клапаны сердца
Среди показаний к проведению чреспищеводного эхокардиографического исследования исследование функции протезированных клапанов сердца занимает первое место [150, 161, 168, 169, 250]. Механические протезы дают выраженную акустическую тень, поэтому при трансторакальном исследовании механический протез в митральной позиции препятствует изучению левого предсердия и митральной регургитации, а протезированный аортальный клапан — задней стенки корня аорты. Чреспищеводное исследование позволяет визуализировать структуры сердца со стороны левого предсердия и потому широко применяется для изучения протезированных клапанов, особенно митрального клапана. Для выявления митральной регургитации, дифференциальной диагностики околоклапанной и трансклапанной регургитации, распознавания бактериального эндокардита протезированных клапанов и его осложнений чувствительность цветного допплеровского сканирования при чреспищеводной эхокардиографии приближается к 100%. По опыту Лаборатории эхокардиографии UCSF примерно у половины пациентов с протезированными клапанами чреспищеводная эхокардиография становится источником новых данных (по сравнению с трансторакальным исследованием), существенных для дальнейшего лечения.
Тромбоз предсердий
Появление тромбоза левого предсердия связано с дилатацией предсердия, наблюдаемой при многих заболеваниях. Тромбоз левого предсердия, по данным разных исследователей, встречается в 10—25% случаев ревматического поражения митрального клапана. Распознавание тромбоза левого предсердия необходимо перед проведением оперативного лечения митрального порока сердца, баллонной вальвулопластики, восстановления синусового ритма. Назначение курса антикоагулянтов на 2—3 недели перед кардиоверсией существенно уменьшает риск тромбоэмболии.
Имеются противоречивые сведения о том, какова чувствительность трансторакальной эхокардиографии для выявления тромбоза левого предсердия. Тромбы левого предсердия чаще всего находятся в его ушке; их очень трудно визуализировать при трансторакальном исследовании. Поскольку тромбоз левого предсердия сопряжен с высоким риском эмболических осложнений, нужно пользоваться более надежным методом выявления тромбов. Чреспищеводная эхокардиография в последние годы стала методом выбора для диагностики тромбоза левого предсердия [233]. Безвоздушное пространство между датчиком и левым предсердием, а также возможность использовать датчик с частотой ультразвука 5,0—7,5 МГц обеспечивают разрешающую способность, достаточную для распознавания тромбов любых размеров и любой локализации (рис. 16.9, 16.10). Кроме того, при чреспищеводной эхокардиографии можно выявить эффект псевдоконтрастирования полости левого предсердия, который нередко обнаруживается при митральном стенозе, мерцательной аритмии, низком сердечном выбросе (рис. 16.10). Этиология этого эффекта до конца не ясна, по-видимому, он связан с замедленным движением эритроцитов, тромбоцитов или комплексов тромбоцитов с нейтрофилами. Однако установлено, что пациенты, у которых обнаруживается псевдоконтрастирование, имеют высокий риск тромбоэмболических осложнений.
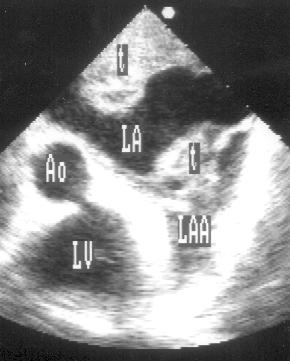
Рисунок 16.9. Тромбоз левого предсердия у пациентки с митральным стенозом: чреспищеводное исследование, поперечная короткая ось на уровне основания сердца. Визуализируются два тромба: в полости левого предсердия и в его ушке. LA — левое предсердие, LAA — ушко левого предсердия, LV — левый желудочек, Ao — корень аорты, t — тромб.
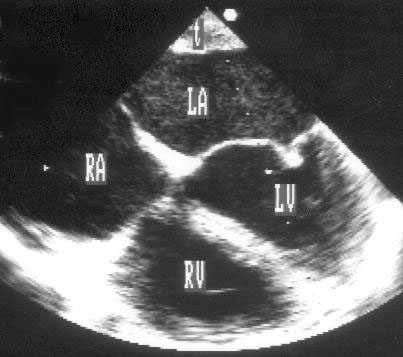
Рисунок 16.10. Тромб и спонтанное контрастирование в полости левого предсердия у пациентки с митральным стенозом: чреспищеводное исследование, позиция четырехкамерного сердца. Эхогенность крови в левом предсердии выше чем в других камерах сердца, при исследовании в реальном времени можно наблюдать перемещение по предсердию мельчайших эхо-позитивных структур — это эффект спонтанного контрастирования. LA — левое предсердие, LV — левый желудочек, RA — правое предсердие, RV — правый желудочек, t — тромб.
Тромбоз правого предсердия тоже распознается при чреспищеводной эхокардиографии с большой точностью. Проведение чреспищеводной эхокардиографии рекомендуется для определения источника тромбоэмболий легочной артерии. Большинство тромбов попадают в правое предсердие из вен нижних конечностей, но возможно их образование в правом предсердии in situ и на поверхности катетеров.
У пациентов с массивной тромбоэмболией легочной артерии при чреспищеводном эхокардиографическом исследовании могут быть выявлены тромбы в стволе легочной артерии и ее ветвях (рис. 16.11).

Рисунок 16.11. Тромбоэмболия легочной артерии: чреспищеводное эхокардиографическое исследование в поперечной плоскости, датчик расположен высоко (базально) в пищеводе. Визуализируется тромб (стрелка) в правой легочной артерии. LA — левое предсердие, RPA — правая легочная артерия, SVC — верхняя полая вена.
Опухоли сердца
Со времени своего появления чреспищеводная эхокардиография применяется для распознавания опухолей сердца [240]. Из-за опасности эмболических осложнений, обструкции кровотока или злокачественности опухоли сердца в подавляющем большинстве случаев удаляют хирургическим путем. Трансторакальное исследование позволяет надежно диагностировать гемодинамические изменения, вызванные опухолями сердца, но иногда оно недостаточно информативно для определения структуры опухоли и места ее прикрепления. Рис. 16.12, 16.13, 16.14 иллюстрируют возможности использования чреспищеводной эхокардиографии для распознавания миксом.
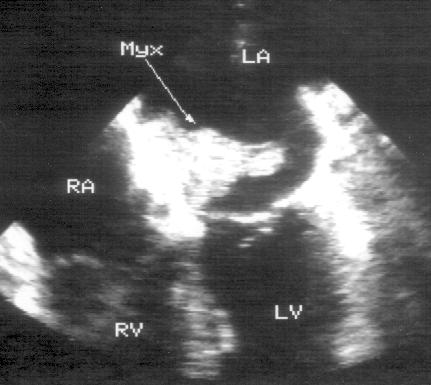
Рисунок 16.12. Миксома левого предсердия: чреспищеводное эхокардиографическое исследование в поперечной плоскости в позиции четырехкамерного сердца. Широким основанием опухоль прикрепляется к межпредсердной перегородке. Миксома практически не кальцифицирована и очень мобильна. Такой тип миксом часто сопровождается эмболическими осложнениями. LA — левое предсердие, LV — левый желудочек, RV — правый желудочек, RA — правое предсердие, Myx — миксома.
A

B
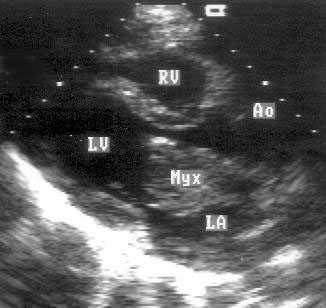
Рисунок 16.13. Миксома левого предсердия: трансторакальное эхокардиографическое исследование из парастернального (А) и апикального доступов (В). Создается впечатление, что миксома прикрепляется к митральному клапану. Ao — восходящий отдел аорты, LA — левое предсердие, LV — левый желудочек, RA — правое предсердие, RV — правый желудочек, Myx — миксома.
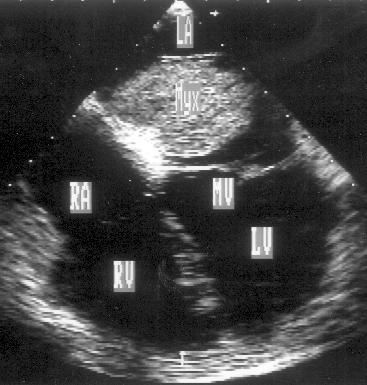
Рисунок 16.14. Миксома левого предсердия у той же больной, что на рис. 16.13: чреспищеводное исследование, позиция четырехкамерного сердца. Видна узкая полоска, отделяющая опухоль от передней створки митрального клапана. Опухоль прикрепляется к межпредсердной перегородке и имеет яркую эхо-структуру (ярче, чем все мягкие ткани), что свидетельствует о содержании в ней большого количества кальция. Яркая эхо-структура и прикрепление к межпредсердной перегородке — характерные признаки миксом. Наличие пространства, отделяющего опухоль от митрального клапана, позволили определить объем операции и провести ее из субкостального хирургического доступа, используя косметический разрез. LA — левое предсердие, LV — левый желудочек, MV — митральный клапан, RA — правое предсердие, RV — правый желудочек, Myx — миксома.
Бактериальный эндокардит
Как уже указывалось в гл. 8, 9, при трансторакальном эхокардиографическом исследовании практически невозможно выявить вегетации размером менее 5 мм. В целом, трансторакальное исследование выявляет вегетации лишь в 50—60% случаев обнаружения их при патолого-анатомическом исследовании или во время операции. Распознавание вегетаций имеет важное диагностическое и прогностическое значение. Так, вегетации на митральном клапане размером более 10 мм, создают более высокий риск эмболических осложнений, чем вегетации меньших размеров. Кроме распознавания вегетаций (рис. 16.15, 16.16, 16.17, 16.18), чреспищеводная эхокардиография при бактериальном эндокардите позволяет диагностировать абсцесс клапанного кольца (рис. 16.19), перфорацию створки, внутрисердечную фистулу.
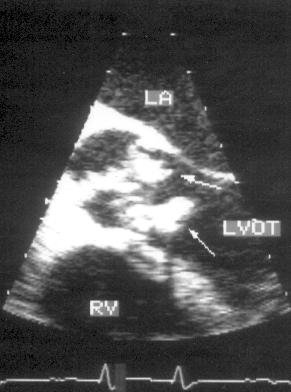
Рисунок 16.15. Бактериальный эндокардит: чреспищеводное эхокардиографическое исследование в поперечной плоскости; позиция выносящего тракта левого желудочка по длинной оси. Вегетации на всех трех створках аортального клапана, пролабирующие в выносящий тракт левого желудочка. LA — левое предсердие, LVOT — выносящий тракт левого желудочка, RV — правый желудочек.

Рисунок 16.16. Бактериальный эндокардит: чреспищеводное эхокардиографическое исследование в поперечной плоскости; позиция выносящего тракта левого желудочка по длинной оси. Вегетации на обеих створках митрального клапана. «Свежие» вегетации имеют нежную эхо-структуру. Вегетации всегда прикрепляются с предсердной стороны створок митрального клапана. LA — левое предсердие, LV — левый желудочек, Ao — корень аорты, veg — вегетации.
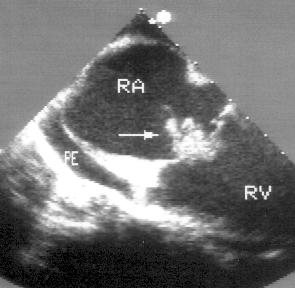
Рисунок 16.17. Бактериальный эндокардит: вегетации на трехстворчатом клапане. Чреспищеводное эхокардиографическое исследование в поперечной плоскости, эндоскоп повернут по часовой стрелке для оптимальной визуализации правых отделов сердца. На предсердной стороне трехстворчатого клапана обнаружены плотные подвижные структуры — вегетации (стрелка). RA — правое предсердие, RV — правый желудочек, PE — небольшой выпот в полости перикарда.
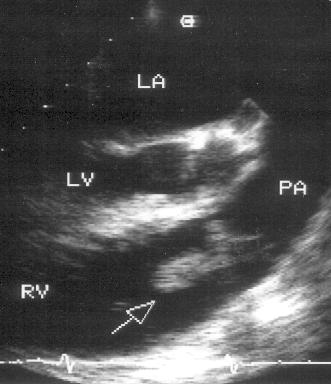
Рисунок 16.18. Бактериальный эндокардит: вегетации на клапане легочной артерии. Чреспищеводное эхокардиографическое исследование в вертикальной плоскости, модифицированная позиция двухкамерного сердца. На клапане легочной артерии — массивные вегетации (стрелка), пролабирующие в выносящий тракт правого желудочка. LA — левое предсердие, LV — левый желудочек, RV — правый желудочек, PA — ствол легочной артерии.

Рисунок 16.19. Осложнение бактериального эндокардита: абсцесс корня аорты. Чреспищеводное эхокардиографическое исследование в поперечной плоскости: позиция выносящего тракта левого желудочка по длинной оси. Поражен весь корень аорты, что практически лишает возможности протезировать аортальный клапан. LA — левое предсердие, LV — левый желудочек, AoV — аортальный клапан, RA — правое предсердие.
Чреспищеводная эхокардиография высоко чувствительна для диагностики бактериального эндокардита [237], но без учета клинических данных может оказаться относительно мало специфичной. Чисто эхокардиографическими способами довольно трудно дифференцировать свежие вегетации от старых, заживших. Трудно также отличить миксоматозную дегенерацию митрального клапана от бактериального эндокардита. Несмотря на эти ограничения, чреспищеводная эхокардиография в сочетании с клиническими данными и результатами бактериологического исследования крови — лучший способ диагностики бактериального эндокардита [248, 249].
Заключая изложение вопроса о диагностике образований (под термином «образования» имеются в виду опухоли, тромбы и вегетации) в полостях сердца, приведем перечень структур (табл. 28), которые ошибочно могут быть приняты за такие образования при чреспищеводном эхокардиографическом исследовании (рис. 16.20, 16.21, 16.22, 16.23, 16.24, 16.25).
Таблица 28. Сердечные структуры, которые ошибочно могут быть приняты за образования при чреспищеводном эхокардиографическом исследовании
Левое предсердие Ткани, отделяющие легочные вены от ушка левого предсердия Трабекуляции в ушке левого предсердия Левая коронарная артерия Аневризма межпредсердной перегородки Рудиментарная «заслонка» овального окна Правое предсердие Сеть Хиари, евстахиев клапан (клапан нижней полой вены) Рудиментарная заслонка sinus venosus Ушко правого предсердия Ткани, разделяющие коронарный синус и верхнюю полую вену Накопление жировой ткани в межпредсердной перегородке (липоматоз) Катетер или зонд-электрод Левый желудочек Папиллярные мышцы Ложные хорды Трабекуляции Аортальный клапан Узелки в месте смыкания створок клапана (узелки Арентиуса) Митральный клапан Нормальные или удлиненные хорды Неровные края (зубцы) створок клапана Протезированные клапаны Шовный материал клапанного кольца

Рисунок 16.20. Нормальные структуры сердца, которые ошибочно могут быть приняты за образования при чреспищеводном эхокардиографическом исследовании: перегородка (стрелка), отделяющая легочные вены от ушка левого предсердия. В ушке левого предсердия хорошо визуализируются трабекуляции, которые ошибочно могут быть приняты за тромбы. Поперечная короткая ось основания сердца, эндоскоп повернут против часовой стрелки для оптимальной визуализации ушка левого предсердия. LA — левое предсердие, LAA — ушко левого предсердия, LUPV — левая верхняя легочная вена.
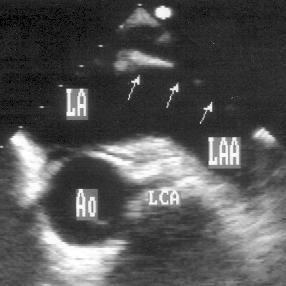
Рисунок 16.21. Нормальные структуры сердца, которые ошибочно могут быть приняты за образования при чреспищеводном эхокардиографическом исследовании: перегородка (стрелки), отделяющая легочные вены от ушка левого предсердия. Поперечная короткая ось основания сердца. LA — левое предсердие, LAA — ушко левого предсердия, Ao — корень аорты, LCA — ствол левой коронарной артерии.

Рисунок 16.22. Нормальные структуры сердца, которые ошибочно могут быть приняты за образования при чреспищеводном эхокардиографическом исследовании: зубцы створок клапана, левая огибающая коронарная артерия (стрелки). Вертикальная двухкамерная позиция. LA — левое предсердие, LV — левый желудочек, LAA — ушко левого предсердия, circ — левая огибающая коронарная артерия.
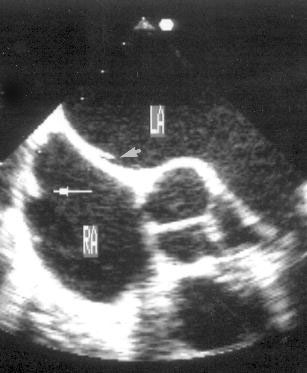
Рисунок 16.23. Нормальные структуры сердца, которые ошибочно могут быть приняты за образования при чреспищеводном эхокардиографическом исследовании: рудиментарная заслонка венозного синуса (в правом предсердии), рудиментарная заслонка овального окна (в левом предсердии). Поперечная короткая ось основания сердца, эндоскоп повернут по часовой стрелке для оптимальной визуализации перегородки и правого предсердия. LA — левое предсердие, RA — правое предсердие.
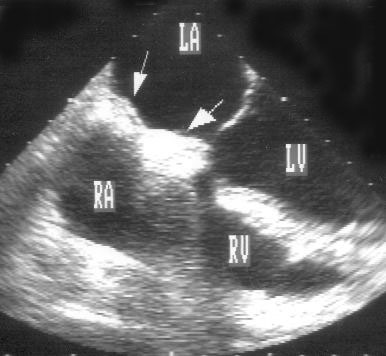
Рисунок 16.24. Липоматоз межпредсердной перегородки: накопление жировой ткани в межпредсердной перегородке в виде «гантелей» (стрелки). Поперечная позиция четырехкамерного сердца, эндоскоп повернут по часовой стрелке для оптимальной визуализации межпредсердной перегородки. LA — левое предсердие, LV — левый желудочек, RA — правое предсердие, RV — правый желудочек.
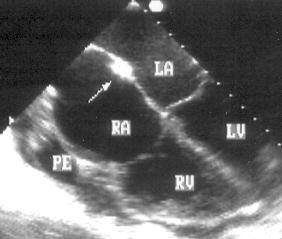
Рисунок 16.25. Чреспищеводное эхокардиографическое исследование пересаженного сердца: место соединения предсердий донора и реципиента (стрелка). Поперечная позиция четырехкамерного сердца. LA — левое предсердие, LV — левый желудочек, RA — правое предсердие, RV — правый желудочек, PE — небольшой выпот в полости перикарда.
Митральная регургитация
Чреспищеводная эхокардиография позволяет с высокой разрешающей способностью визуализировать митральный клапан со стороны левого предсердия. Допплеровское чреспищеводное исследование, особенно цветное сканирование, — надежный метод диагностики митральной регургитации: акустическая тень от протезированного клапана или кальцинированного митрального кольца не мешает в этом случае исследованию (рис. 17.4, 17.12, 17.13, 17.14, 17.15).
В последнее время все протезирование митрального клапана все больше уступает место реконструктивным операциям. Самыми частыми показаниями к их проведению служат миксоматозная дегенерация и молотящая створка клапана. Чреспищеводная эхокардиография с большой точностью диагностирует эту патологию и позволяет определить этиологию митральной недостаточности на сокращающемся сердце перед хирургическим вмешательством. Интраоперационное определение адекватности оперативного лечения по поводу митральной недостаточности стало одной из областей рутинного применения чреспищеводной эхокардиографии. По нашему мнению, каждая операция на клапанах сердца должна сопровождаться эхокардиографическим контролем ее эффективности сразу после отключения искусственного кровообращения и восстановления самостоятельного кровообращения. При обнаружении средней или тяжелой клапанной регургитации можно возобновить искусственное кровообращение и произвести повторную реконструкцию клапана или его протезирование.
Расслаивающая аневризма аорты
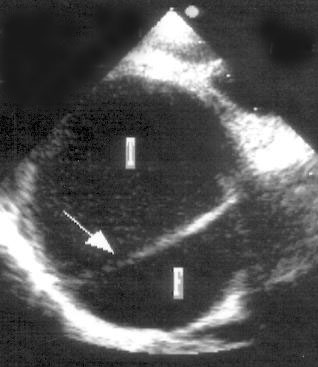
Чреспищеводная эхокардиография служит надежным методом распознавания как острой, так и хронической расслаивающей аневризмы аорты [225, 236]. Основной диагностический признак расслаивающей аневризмы аорты — отслойка участка интимы с образованием истинного и ложного каналов (рис. 16.26). С помощью цветного сканирования можно выявить место отслойки интимы и затекания крови в ложный канал, дилатацию аорты и аортальную регургитацию. Двухплоскостные датчики позволяют визуализировать аорту в продольном сечении на большом протяжении. Чреспищеводная эхокардиография обладает большей чувствительностью для диагностики расслаивающей аневризмы аорты (более 90%), чем рентгеноконтрастная ангиография и по своей диагностической ценности не уступает компьютерной томографии. При подозрении на расслаивающую аневризму аорты чреспищеводная эхокардиография выполняется непосредственно у постели больного, что может сэкономить время в экстренной ситуации [222]. Несмотря на полуинвазивный характер исследования, чреспищеводная эхокардиография хорошо переносится такими пациентами, особенно при назначении более высоких, чем обычно, доз седативных препаратов, предотвращающих гипертоническую реакцию на интубацию пищевода.

A
B
Рисунок 16.26. Проксимальная расслаивающая аневризма аорты: чреспищеводное эхокардиографическое исследование дуги аорты (А) и восходящего отдела аорты (В) в поперечной плоскости. Участок отслоившейся интимы обозначен стрелкой. Ложный и истинный каналы распознаны с помощью цветного допплеровского сканирования. F — ложный канал, Т — истинный канал.
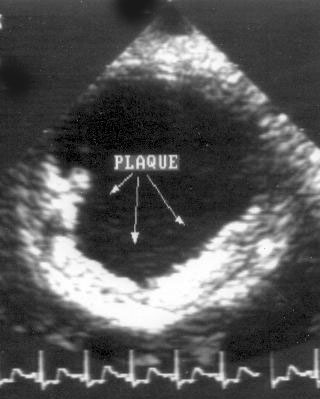
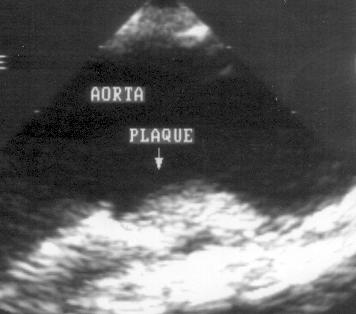
При исследовании аорты также следует обращать внимание на строение ее стенки и атеросклеротические бляшки. На рис. 16.27 приведены изображения атеросклеротических бляшек, обнаруженных при чреспищеводном эхокардиографическом исследовании.
A
B
Рисунок 16.27. Атеросклеротические бляшки в нисходящем отделе (А) и в дуге аорты (В). Чреспищеводное эхокардиографическое исследование аорты в поперечной плоскости. PLAQUE — атеросклеротическая бляшка.
Врожденные пороки сердца
Чреспищеводное исследование в ряде случаев может стать важным дополнением к трансторакальной эхокардиографии в диагностике врожденных пороков сердца. Чреспищеводную эхокардиографию можно проводить не только у взрослых, но и у детей: для исследования детей младше 7 лет разработаны специальные эндоскопы (диаметром 7 мм). Двумерное чреспищеводное исследование позволяет хорошо визуализировать дефекты межпредсердной и межжелудочковой перегородки, а контрастное исследование и цветное сканирование — определить гемодинамическую значимость внутрисердечного шунтирования крови. Чреспищеводная эхокардиография является методом выбора для дифференциальной диагностики дефектов межпредсердной перегородки типа sinus venosus и ostium secundum. С помощью чреспищеводного исследования хорошо диагностируется коарктация аорты.
Интраоперационная чреспищеводная эхокардиография при врожденных пороках сердца [179] имеет преимущества перед эпикардиальной эхокардиографией: она не заставляет прерывать операцию и позволяет непрерывно следить за функцией левого желудочка, а также контролировать закрытие дефектов межпредсердной и межжелудочковой перегородки [185]. Мониторинг функции левого желудочка особенно важен при оперативном лечении коарктации аорты: дилатация левого желудочка и ухудшение его глобальной сократимости требуют срочного вмешательства в ход операции.
Чреспищеводная эхокардиография в блоке интенсивной терапии
Все большее распространение получает применение чреспищеводной эхокардиографии в кардиологических блоках интенсивной терапии и реанимационных терапевтических и хирургических отделениях. Чреспищеводная эхокардиография эффективно заменяет трансторакальное исследование в ситуациях, когда последнее затруднено или невозможно [241, 243].
Контроль эффективности лечения тяжелых кардиологических больных часто основан на измерении давления заклинивания легочной артерии как эквивалента конечно-диастолического давления левого желудочка. По этому показателю судят об уровне преднагрузки на левый желудочек, иными словами, о конечно-диастолическом объеме левого желудочка. Однако известно, что при резких изменениях податливости левого желудочка, конечно-диастолическое давление в нем может достигать высоких цифр при нормальном или даже пониженном объеме. Это несоответствие давления объему особенно ярко проявляется после применения искусственного кровообращения. В такой ситуации ориентация на давление заклинивания легочной артерии может привести к неверным клиническим решениям. С помощью чреспищеводной эхокардиографии удается гораздо полнее и точнее исследовать функцию сердца.
Кроме того, чреспищеводная эхокардиография позволяет быстро диагностировать осложнения инфаркта миокарда: разрывы миокарда, митральную регургитацию.
Интраоперационная чреспищеводная эхокардиография
Чреспищеводная эхокардиография нашла широкое применение для мониторинга локальной сократимости левого желудочка и функции сердца во время кардиохирургических и других вмешательств [226, 234, 239, 244, 251]. Особенно важна ее роль при высоком риске оперативного лечения из-за: сопутствующей патологии, преклонного возраста пациентов, ишемической болезни сердца, исходно нарушенной глобальной сократимости левого желудочка или заболеваний периферических артерий. Интраоперационная чреспищеводная эхокардиография гораздо чувствительнее для распознавания ишемии или инфаркта миокарда, чем изучение давления заклинивания легочной артерии или изменений сегмента ST электрокардиограммы. Все большее число анестезиологов осваивают чреспищеводную эхокардиографию. Непосредственно во время операции качественно оценивают изменения сократимости левого желудочка на уровне папиллярных мышц из трансгастрального доступа (рис. 16.28). В отличие от клинической практики, большинство научных исследований, посвященных интраоперационному применению чреспищеводной эхокардиографии, основано на изучении видеозаписей. Все исследователи согласны в том, что интраоперационная эхокардиография имеет высокую специфичность (около 90%) для выявления ишемии миокарда, но чувствительность метода колеблется между 46% и 100%. Ограничения метода связаны с тем, что левый желудочек исследуется только по короткой оси, поэтому в срез не попадают верхушечные сегменты, и нельзя оценить движение основания сердца. Кроме того, быстрое распознавание новых нарушений локальной сократимости может быть затруднено из-за наличия сегментов с исходно нарушенной сократимостью или глобальной систолической дисфункцией левого желудочка. Преодолеть эти трудности помогут двухплоскостные датчики, цифровая эхокардиография и методы автоматизированной количественной оценки сократимости.
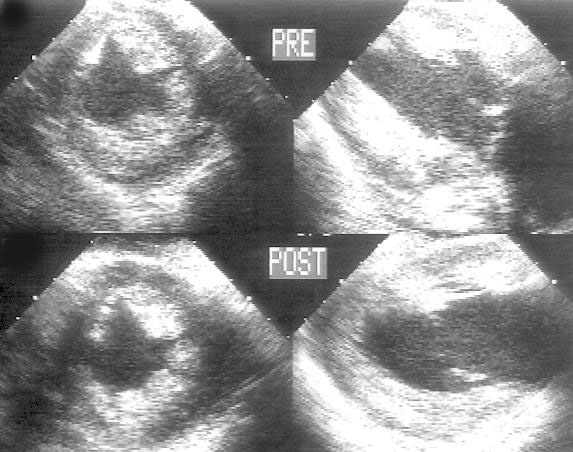
Рисунок 16.28. Интраоперационный мониторинг функции левого желудочка: чреспищеводное исследование перед включением (PRE) и после отключения искусственного кровообращения (POST). Слева — трансгастральная короткая ось левого желудочка (в поперечной плоскости); справа — трансгастральная длинная ось левого желудочка (в вертикальной плоскости).
Интраоперационная чреспищеводная эхокардиография позволяет изучать не только сократимость левого желудочка, но и его объемы. Выше мы говорили о важности определения конечно-диастолического объема левого желудочка и о ненадежности такого показателя, как давление заклинивания легочной артерии, для выбора лечебной тактики. Интраоперационное эхокардиографическое исследование диастолических размеров левого желудочка по его короткой оси обнаруживает изменения преднагрузки с такой высокой чувствительностью, что на этой основе можно корректировать введение жидкости и вазоактивных препаратов.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКЧитайте также
Глава 3. Допплер-эхокардиография: физические принципы и основные измерения
Глава 3. Допплер-эхокардиография: физические принципы и основные измерения Физические принципы допплеровского исследования кровотокаЭффект Допплера, на котором основано ультразвуковое исследование кровотока, состоит в том, что частота звука, издаваемого движущимся
Глава 15. Стресс-эхокардиография
Глава 15. Стресс-эхокардиография Для неинвазивной диагностики ишемической болезни сердца используют нагрузочные пробы в сочетании с различными методами распознавания ишемии. Наиболее распространенным методом выявления ишемии миокарда является изучение изменений
Эхокардиография
Эхокардиография Суть метода: эхокардиография — метод ультразвукового исследования сердца, позволяющий оценить морфо-функциональные параметры структур сердца. Используются несколько режимов эхокардиографии: М-режим (одномерная эхокардиография), двухмерная
Чреспищеводная электрокардиография
Чреспищеводная электрокардиография Суть метода: чреспищеводная электрокардиография — метод записи ЭКГ с электрода, помещенного в пищевод исследуемого. По данным чреспищеводной электрокардиографии выявляются и дифференцируются различные виды нарушений
Эхокардиография
Эхокардиография Суть метода: эхокардиография – метод ультразвукового исследования сердца, позволяющий оценить морфофункциональные параметры структур сердца. Используются несколько режимов эхокардиографии: М-режим (одномерная эхокардиография), двухмерная
Чреспищеводная эхокардиография
Чреспищеводная эхокардиография Суть метода: чреспищеводная эхокардиография – метод ультразвукового исследования сердца, при котором УЗ-датчик вводится с помощью эндоскопа. Чреспищеводная эхокардиография дает более четкую визуализацию структур сердца, чем
Стресс-эхокардиография
Стресс-эхокардиография Суть метода: стресс-эхокардиография – метод эхокардиографии, выполняющийся под нагрузкой. Стресс-эхокардиография позволяет оценить реакцию сердца на стрессовое воздействие, вызванное различными вариантами нагрузок: физическими
Чреспищеводная электрокардиография
Чреспищеводная электрокардиография Суть метода: чреспищеводная электрокардиография – метод записи ЭКГ с электрода, помещенного в пищевод исследуемого. По данным чреспищеводной электрокардиографии выявляются и дифференцируются различные виды нарушений
Глава 12
Глава 12 Человек не должен заниматься своим здоровьем, это должно быть его естественным состоянием, как результат естественной жизни. – Послушай, Гея, а как у вас дела обстоят с лечением? – спросил Петрович.– Болезней как таковых у нас нет. Чаще всего у нас бывают ушибы,
Глава 13
Глава 13 Тело, полученное живым существом от материальной природы, определяет уровень его сознания; степень развития сознания определяет характер его деятельности, а чистота этой деятельности определяет его способности постичь Верховного Господа, пребывающего в сердце
Глава о неприличных словах Глава 3
Глава о неприличных словах Глава 3 Вы можете заинтересоваться, почему глава о неприличных словах расположена в самом начале этой замечательной в остальном книги. Наверное, в этой главе есть нечто больше, чем просто неприличные слова. Эта глава, так же как и другие в этой
Эхокардиография
Эхокардиография Эхокардиография, или УЗИ сердца, – метод, основанный на свойстве ультразвуковых волн отражаться от тканей органов. В зависимости от состояния последних волны определенным образом видоизменяются. Преобразованные в электрические сигналы звуковые волны