Препараты, стимулирующие костное новообразование
Фториды
Следует упомянуть, что большее число исследований по изучению эффективности фторидов неконтролируемые, при этом разные дозы и формы препаратов не дают возможности провести сравнительный анализ.
О большей адекватности протоколов исследования можно говорить в исследованиях, представленных в табл. 14, с плацебоконтролем, ни в одном из которых не было доказано эффективности фторидов в предотвращении остеопоротических переломов.
Паратиреоидный гормон
В паращитовидных железах человека исходно синтезируется препропаратиреоидный гормон, состоящий из 115 аминокислот, который в течение 1 минуты распадается на пропаратиреоидный гормон, состоящий из 90 аминокислот. Из пропаратиреоидного гормона, в свою очередь, образуется биологически активный паратиреоидный гормон, содержащий 84 аминокислоты, который циркулирует в тканях.
Таблица 14
Клинические исследования эффективности фторидов в предотвращении остеопоротических переломов

В печени, почках, костях и паращитовидных железах биологически активный ПТГ распадается на С-концевой, срединный и N-концевой фрагменты. Биологической активностью обладает N-концевой фрагмент молекулы. Экспериментальный синтез большого количества фрагментов ПТГ показал, что N-концевая часть ПТГ, содержащая первые 34 аминокислоты, имеет такой же биологический эффект, как и ПТГ 1–84.
В костях ПТГ (1–34) связывается с высокой аффинностью со специфическим G-протеином, связанным с РТН/РТНгР (паратгормонподобный пептид) рецептором.
Хотя имеются новые достижения в понимании молекулярных и клеточных событий, ассоциирующихся с активностью ПТГ-рецептора, полная картина механизмов изменения костного формирования при воздействии ПТГ 1–34 остается неизвестной.
Анаболический эффект ПТГ может быть объяснен доказательством увеличения продолжительности жизни остеобластов, уменьшением частоты их апоптоза, но не влиянием на поколения новых остеобластов.
К настоящему времени показано, что интермиттирующее воздействие ПТГ стимулирует костеобразование на трабекулярных и кортикальных костных поверхностях за счет увеличения количества и активности остеобластов. Это приводит к преобладанию костного формирования над костной резорбцией на индивидуальных ремоделирующихся участках.
Клиническая фармакология препаратов ПТГ
В 1999 г. было опубликовано два рандомизированных плацебоконтролируемых исследования по оценке влияния семипаратида (ПТГрП 1–34) на МПК у женщин с постменопаузальным остеопорозом. В обоих исследованиях приняли участие соответственно 64 и 63 женщины. Семипаратид (СМП) назначался подкожно ежедневно в течение 6 мес. В дозах 12,5, 25, 50 или 100 мкг вместе с 1000 мг кальция. В последующие 6 мес. пациенты 1-й группы получали только кальций, а 2-й – кальций и 10 мг алендроната.
Существенное увеличение МПК наблюдалось при применении 50 и 100 мкг СМП. 100 мкг СМП повышали МПК в позвонках на 5 % через 3 мес. И на 9 % через 6 мес. МПК в области Total hip возрастала на 1,2 % через 6 мес. лечения на дозе 50 мкг и на 3,2 % – на дозе 100 мкг. В последующие 6 мес. наблюдения сохранялся прирост МПК в 1-й группе, и МПК продолжала увеличиваться на фоне последующего лечения алендронатом. Результаты исследования показывают, что ежедневное применение СМП при постменопаузальном ОП приводит к быстрому и достоверному увеличению МПК в позвонках и бедре, которое сохраняется через 6 мес. после прекращения лечения и продолжает расти при последующем лечении алендронатом.
Наибольшей статистической мощностью обладает исследование Neer 2001, в которое было включено 1637 женщин в постменопаузе с диагностированным остеопорозом для изучения эффективности ПТГ 1–34 (терипаратида). По результатам этого исследования в зависимости от дозы препарата (20 и 40 мкг) было выявлено повышение МПК позвоночника на 9,7 и 13,7 %, повышение МПК шейки бедра на 2,8 и 5,1 % соответственно. При анализе динамики МПК в поясничных позвонках положительный ответ на лечение отмечен у 96 % женщин. При оценке МПК дистальных отделов лучевой кости на фоне лечения терипаратидом было выявлено уменьшение МПК в группе лечения в сравнении с плацебо, но это не влияло на частоту переломов костей запястья. Последующий статистический анализ данного исследования показал, что положительный эффект терипаратида не зависит от исходной МПК, наличия и количества предшествующих переломов костей, а также возраста и тяжести заболевания у женщин с остеопорозом в постменопаузе.
Для оценки качества кортикальной кости проводилась периферическая компьютерная томография дистального отдела недоминантной лучевой кости у 101 женщины из включенных в исследование Neer, после 18 месяцев терапии терипаратидом (35 из них получали инъекции плацебо, 38 – терипаратид 20 мкг и 28–40 мкг). У пациенток, получавших лечение терипаратидом, были достоверно выше общее минеральное содержание, площадь кортикальной кости, периостальные и эндокортикальные окружности, а также осевые и полярные моменты инертности поперечного сечения, отражающие свойства прочности костной ткани.
У 51 женщины из включенных в исследование Neer (19 женщин из группы плацебо, 18 – из группы, которые находились на лечении 20 мкг терипаратида, и 14 женщин, которые получали 40 мкг) была проведена биопсия подвздошной кости. Образцы были проанализированы с использованием двухмерной гистоморфометрии и трехмерной микрокомпьютерной томографии. При проведении двухмерной гистоморфометрии наблюдалось достоверное увеличение объема трабекулярной кости при лечении терипарадидол на 14 % и уменьшение этого показателя в группе плацебо на 24 %, а также уменьшение объема костного мозга в группах, получавших терипаратид по сравнению с группой плацебо. В группах, получавших терипаратид, отмечалось также недостоверное утолщение костных трабекул по сравнению с плацебо. У пациентов, получавших терипаратид, не было выявлено признаков остеомаляции или остеосклероза. При трехмерной компьютерной томографии терипаратид достоверно уменьшал структурный моделирующий индекс трабекулярной кости, увеличивал плотность соединения и толщину трабекул. Эти результаты могут свидетельствовать об улучшении биомеханической прочности костной ткани и соответственно уменьшении риска переломов.
В течение 18 месяцев после завершения лечения терипаратидом 77 % пациенток из включенных в исследование Neer оставались под наблюдением исследовательской группы. Пациенткам могла быть назначена дополнительная терапия остеопороза по усмотрению лечащего врача. При анализе частоты новых переломов костей после 18-месячного периода наблюдения оказалось, что вне зависимости от получаемой в этот период антиостеопоретической терапии или ее отсутствия у женщин, лечившихся ранее терипаратидом, достоверно реже возникали новые как вертебральные, так и внепозвоночные переломы.
Результаты ряда доказательных исследований последовательной терапии терипаратидом и алендронатом определили предпосылки возможности комбинированного лечения терипаратидом и бисфосфонатами. Предполагалось, что бисфосфонаты, уменьшая костную резорбцию, позволят достичь лучшего увеличения МПК. Однако комбинированное лечение терипаратидом и алендронатом одновременно оказалось менее эффективным, чем лечение только терипаратидом. Это было показано в РКИ с участием 238 женщин в постменопаузе, сходный эффект был получен в РКИ 83 мужчин старшего возраста.
Терипаратид (форстео)
Характеристика
Рекомбинантный человеческий паратиреоидный гормон, получаемый с использованием штамма Escherichia coli (с помощью технологии рекомбинирования ДНК).
Фармакокинетика
Хорошо всасывается при п/к введении. Абсолютная биодоступность – 95 %. Объем распределения – 1,7 л/кг. Tсmax – 30 мин после п/к введения 20 мкг препарата, Cmax превышает в 4–5 раз верхнюю границу нормальной концентрации паратгормона, с последующим ее снижением до неопределяемых величин в течение 3 ч. T1/2 – 1 ч. Метаболизируется в печени посредством неспецифических ферментативных механизмов с последующим выведением через почки.
Подобно эндогенному паратгормону, терипаратид не кумулируетя в костях или др. тканях. Влияния возраста (возрастная группа от 31 до 85 лет) на фармакокинетику терипаратида не отмечено. У пациентов с ХПН легкой или умеренной степени тяжести (КК 30–72 мл/мин) фармакокинетика не изменяется.
Противопоказания
Гиперчувствительность, предшествующая гиперкальциемия, тяжелая ХПН, метаболические заболевания костей, за исключением первичного остеопороза (включая гиперпаратиреоз и болезнь Педжета), повышение активности ЩФ неясного генеза, предшествующая лучевая терапия костей скелета, метастазы в кости или опухоли костей в анамнезе, беременность, период лактации, возраст до 18 лет. C осторожностью: мочекаменная болезнь (в стадии обострения или недавно перенесенная); ХПН умеренно выраженная, гиповитаминоз D, гипокальциемия (клинически значимая), одновременный прием сердечных гликозидов.
Режим дозирования
П/к в область бедра или живота, 1 раз в день, в дозе 20 мкг. Максимальная продолжительность лечения – 18 мес.
Побочные эффекты
Наиболее часто (более 10 %): боли в конечностях. Часто (более 1 % и менее 10 %): анемия, гиперхолестеринемия, депрессия, головная боль, головокружение, ишиас, сердцебиение, одышка, диспноэ, тошнота, рвота, повышенное потоотделение, мышечные судороги, общая слабость, боль в грудной клетке, астения. Редко (более 0,1 % и менее 1 %): тахикардия, снижение АД, эмфизема, недержание мочи, полиурия, болезненные позывы к мочеиспусканию, эритема и раздражение в месте введения. Передозировка. Симптомы: продолжительная гиперкальциемия, ортостатический коллапс, тошнота, рвота, головокружение, головная боль. Лечение: отмена препарата, контроль концентрации сывороточного Ca2+, симптоматическая терапия. Специфического антидота нет.
Особые указания
В случае перерыва в лечении препаратом пациенты могут продолжать лечение другими ЛС. Рекомендуется дополнительное назначение кальция и витамина D в случае недостаточного поступления с пищей. Забор крови для определения концентрации Ca2+ в крови следует производить не ранее чем через 16 ч после последнего введения препарата в связи с возможной кратковременной гиперкальциемией после введения терипаратида. Постоянного контроля концентрации Ca2+ во время лечения не требуется. При приеме препарата могут наблюдаться редкие эпизоды кратковременной ортостатической гипотензии, которые возникают в течение 4 ч после введения препарата и проходят самостоятельно в течение от нескольких минут до нескольких часов (пациента необходимо уложить в горизонтальное положение, лежа на спине) и не являются противопоказанием для дальнейшего введения препарата. Ввиду недостатка клинических данных при длительном лечении терипаратидом, рекомендуемые сроки лечения не должны превышать 18 мес. Препарат не подлежит использованию, если раствор в шприц-ручке мутный, окрашен или содержит инородные частицы.
Взаимодействие
Клинически значимого взаимодействия с гидрохлоротиазидом и фуросемидом не отмечено. Совместное назначение терипаратида с ралоксифеном или гормонозаместительной терапией не влияет на концентрацию Ca2+ в сыворотке крови и в моче. Однократное введение терипаратида не оказывает влияния на фармакодинамику дигоксина. Гиперкальциемия является предрасполагающим фактором к развитию интоксикации препаратами дигиталиса.
Деносумаб
Результатом разработки новой концепции – синтеза «таргетного» препарата для лечения постменопаузального остеопороза стал синтез специфического, высокоаффинного человеческого моноклонального антитела (изотип иммуноглобулина IgG2) с высокой степенью аффинности к лиганду рецептора активатора ядерного фактора kB (RANKL). Он создан по технологии XenoMouse®, позволяющей производить у мышей человеческие антитела вместо мышиных. Деносумаб – эффективный ингибитор костной резорбции. Связывая RANKL подобно ОПГ, деносумаб предотвращает взаимодействие RANK с RANKL, снижает дифференциацию, активность и жизнеспособность ОК, подавляя таким образом костную резорбцию.
Было установлено, что эффективной дозой является 60 мг деносумаба. Каждые шесть месяцев предлагается использовать инъекцию Деносумаба подкожно, в состав инъекции входит 1 мл деносумаба. Длительность эффекта 60 мг деносумаба составляет около 6 месяцев.
Исследования, в которых деносумаб сравнивали с другими человеческими моноклональными антителами, показали, что препарат имеет нелинейную фармакинетику. Исследования похожих IgG-антител позволяют выдвинуть гипотезу о том, что деносумаб адсорбируется лимфатической системой, а затем поступает в сосудистое русло. Клиренс деносумаба осуществляется двумя способами: один из них – непосредственное связывание с RANKL. Именно этот механизм обусловливает «таргетное» распределение препарата. А другой – неспецифический катаболизм препарата клетками ретикулоэндотелиальной системы. Биологическая доступность составляет от 50 до 100 %.
При исследовании фармакокинетики в исследовании первой фазы с повышением доз при единичной инъекции деносумаба у 49 здоровых женщин наблюдались три этапа: продолжительная фаза адсорбции с максимальным содержанием в сыворотке крови на 5–21-й день после инъекции; длительная бета-фаза с периодом полужизни 32 дня при максимальной дозе и быстрая завершающая фаза, при которой содержание препарата в сыворотке опустилось ниже отметки 1000 нг/мл.
Механизм действия (информация из инструкции препарата)
Деносумаб представляет собой полностью человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к лиганду рецептора активатора ядерного фактора ?В (RANKL), и тем самым препятствует активации единственного рецептора RANKL – активатора ядерного фактора ?В (RANK), расположенного на поверхности остеокластов и их предшественников.
Таким образом, предотвращение взаимодействия RANKL/RANK ингибирует образование, активацию и продолжительность существования остеокластов. В результате деносумаб уменьшает костную резорбцию и увеличивает массу и прочность кортикального и трабекулярного слоев кости.
Фармакодинамические эффекты
Назначение деносумаба в дозе 60 мг приводило к быстрому уменьшению сывороточных концентраций маркера резорбции костной ткани – 1С-телопептида (СТХ) – приблизительно на 70 % в течение 6 ч после подкожного введения и приблизительно на 85 % в течение последующих 3 дней. Уменьшение концентрации СТХ оставалось стабильным в 6-месячном интервале между дозированием. Скорость снижения концентрации СТХ в сыворотке крови частично уменьшалась при снижении концентрации деносумаба в сыворотке крови, что отражает обратимость влияния деносумаба на ремоделирование кости.
Данные эффекты наблюдались на протяжении всего курса лечения. Соответственно физиологической взаимосвязи процессов образования и резорбции при ремоделировании костной ткани наблюдалось уменьшение содержания маркеров образования кости (например, костноспецифической ЩФ и сывороточного N-концевого пропептида коллагена I типа) с первого месяца после введения первой дозы деносумаба. Маркеры ремоделирования кости (маркеры образования кости и резорбции кости), как правило, достигали концентраций периода до начала лечения не позднее чем через 9 мес. после приема последней дозы препарата. После возобновления лечения деносумабом степень снижения концентраций СТХ была сходна со степенью снижения концентрации СТХ в начале курса лечения деносумабом.
Было показано, что перевод с лечения алендроновой кислотой (средняя продолжительность применения – 3 года) на деносумаб приводит к дополнительному снижению концентрации СТХ в сыворотке по сравнению с группой женщин в постменопаузе с низкой костной массой, продолжавших лечение алендроновой кислотой. В то же время изменения содержания кальция в сыворотке были одинаковыми в обеих группах.
В экспериментальных исследованиях ингибирование RANK/RANKL одновременно со связыванием остеопротегерина с Fc-фрагментом (ОПГ-Fc) приводило к замедлению роста кости и нарушению прорезывания зубов. Поэтому лечение деносумабом может тормозить рост костей с открытыми зонами роста у детей и приводить к нарушениям прорезывания зубов.
Иммуногенность
Деносумаб – человеческое моноклональное антитело, поэтому, как и для других ЛС белковой природы, существует теоретический риск иммуногенности. Более чем 13 000 пациентов были обследованы на предмет образования связывающих антител с использованием метода чувствительной электрохемилюминесценции в сочетании с иммунологическим анализом. Менее чем у 1 % пациентов, принимавших деносумаб в течение 5 лет, определялись антитела (включая существовавшие ранее, транзиторные и растущие). Серопозитивные пациенты были далее обследованы на предмет образования нейтрализующих антител, используя хемилюминесцентный анализ в культуре клеток in vitro, нейтрализующих антител не обнаружено. Не было выявлено изменений фармакокинетического профиля, токсического профиля или клинического ответа, обусловленных образованием антител.
В 2004 году были опубликованы результаты исследований деносумаба первой фазы у здоровых женщин в постменопаузе. С этого времени были проведены многочисленные исследования деносумаба у женщин с постменопаузальным остеопорозом (ПМО).
В исследовании деносумаба второй фазы проводилась оценка эффективности и безопасности деносумаба, а также были изучены эффекты прекращения и возобновления терапии у женщин в постменопаузе с пониженной минеральной плотностью кости (МПК). В исследовании приняли участие 412 женщин, имеющих T-показатель поясничного отдела позвоночника от –1,8 до –4,0, общий показатель бедра или шейки бедра – от –1,8 до –3,5. Средний возраст составил 63 года. Испытуемые были разделены на 9 групп по 41–45 человек в каждой, участники получали подкожные инъекции деносумаба в дозе 6, 14 или 30 мг каждые 3 месяца или 14, 60, 100, 210 мг каждые 6 месяцев; открытый прием 70 мг алендроната еженедельно или плацебо. Все испытуемые ежедневно употребляли кальций (1000 мг) и витамин D (400 МЕ). 90 % (369) пациенток оставались в исследовании в течение 12 месяцев.
В первые 24 месяца изучали эффекты различных доз деносумаба. Затем с 24-го по 48-й месяц оценивали результаты прекращения и возобновления терапии. В дальнейшем была проведена 24-месячная продленная фаза. На этом этапе пациентки всех групп получали деносумаб в дозе 60 мг каждые 6 месяцев. Первичной конечной точкой исследования было относительное отклонение от исходного МПК поясничного отдела позвоночника через 12 месяцев.
На 12-м месяце от начала исследования прирост МПК на фоне деносумаба составил от 3,0 до 6,7 % в зависимости от дозы и интервала приема препарата, при этом в группе плацебо отмечено снижение МПК – 0,8 % (р < 0,001). Показатели МПК общего бедра на деносумабе увеличились на 1,9–3,6 % против потери 0,6 % (р < 0,001) в группе плацебо; в лучевой кости – увеличение на 0,4–1,3 % против потери в группе плацебо 2 % (p < 0,001). Достоверное снижение маркера костной резорбции С-телопептида (СТХ) в сыворотке крови по сравнению с плацебо отмечено на 3-й день после инъекции (р < 0,001). Содержание СТХ максимально снизилось в среднем на 87,8 % в группе деносумаба и на 4,2 % – в группе плацебо. 337 пациенток (81,8 %) завершили 24-месячное исследование. Через 24 месяца терапии показатели МПК поясничного отдела позвоночника повысились на 4,13–8,89 % в группе деносумаба по сравнению со снижением на 1,18 % в группе плацебо (p < 0,001 для всех доз деносумаба по сравнению с плацебо).
Лечение деносумабом в дозе 30 мг каждые 3 месяца или 60 мг каждые 6 месяцев показало сходный с алендронатом эффект на МПК позвоночника и более выраженный эффект на показатели общего бедра и дистальный отдел лучевой кости. Результаты свидетельствовали о том, что 60 мг деносумаба каждые 6 месяцев и 30 мг каждые 3 месяца обеспечивали оптимальный терапевтический эффект при относительно минимальной дозе препарата. В течение 24 месяцев исследования второй фазы нежелательные явления (НЯ) для групп, употреблявших деносумаб, плацебо и алендронат, оставались примерно равными. Случаев появления нейтрализующих антител зафиксировано не было.
Данное исследование II фазы было продлено дополнительно на 24 месяца. Пациентки, получавшие деносумаб в дозе 6, 14 мг каждые 3 месяца, и женщины, получавшие 14, 60 и 100 мг каждые 6 месяцев, в дальнейшем были переведены на деносумаб в дозе 60 мг каждые 6 месяцев. Пациентки, получавшие 210 мг раз в 6 месяцев, в дальнейшем получали плацебо до конца исследования. Пациентки, получавшие 30 мг деносумаба раз в 3 месяца в течение 12 месяцев, в течение последующих 12 месяцев принимали плацебо, а затем 60 мг деносумаба раз в 6 месяцев в последующие 12 месяцев. Пациентки, получавшие алендронат в течение 24 месяцев, в дальнейшем не получали никакого лечения. Группа плацебо не меняла терапии в течение всех 48 месяцев исследования. Из 412 пациенток, исходно включенных в исследование, 64 % (262) получали препараты в течение 48 месяцев.
На фоне длительной терапии деносумабом прибавка МПК составила 9,4–11,8 % в поясничном отделе позвоночника и 4–6,1 % в общем бедре. Показатели костной резорбции были снижены на протяжении всех 48 месяцев лечения. Прекращение терапии деносумабом через 12 месяцев сопровождалось снижением МПК поясничного отдела позвоночника на 6,6 % и на 5,3 % в общем бедре, а также повышением показателей маркеров костного ремоделирования (МКР), что свидетельствует об обратимости эффекта.
В исследовании было выявлено, что профиль соотношения риска и пользы можно считать приемлемым, требующим дальнейшего изучения. Наиболее частыми НЯ были инфекции верхних дыхательных путей, артралгия, боли в спине. Профиль безопасности деносумаба не изменялся со временем. Длительное лечение деносумабом в течение всего периода наблюдения приводило к прогрессирующему увеличению МПК и к снижению уровней МКР по сравнению с плацебо. Кроме того, независимо от предшествовавшего периода лечения или его прекращения, был продемонстрирован ответ на терапию у всех пациенток.
Сравнение эффективности и безопасности деносумаба и алендроната (биcфосфоната, широко применяющегося при лечении остеопороза) было проведено в ходе исследования третьей фазы DECIDE. Оценивали влияние препаратов на МПК и биохимические МКР у женщин в постменопаузе с низкой костной массой. В исследовании приняли участие 1189 женщин (две равные группы по 594 человека) в постменопаузе, в целом обладающие хорошим здоровьем, с Т-показателем бедра и поясничного отдела позвоночника от –2,0 и ниже. Участницы одной группы получали 1 мл раствора деносумаба (60 мг) каждые 6 месяцев и таблетку плацебо перорально еженедельно, другой группе раз в полгода делали инъекции 1 мл плацебо и раз в неделю давали таблетку алендроната (70 мг). Все женщины ежедневно принимали не менее 500 мг кальция и витамин D.
Среднее процентное изменение МПК в общем показателе бедра за 12 месяцев с начала исследования у принимавших деносумаб составило 3,5 %, у принимавших алендронат – 2,6 % (р < 0,0001). Деносумаб продемонстрировал увеличение МПК вертела бедренной кости на 4,5 % (3,4 % для алендроната), лучевой кости – на 1,1 % (0,6 % для алендроната), шейки бедра – на 2,4 % (1,8 % для алендроната), поясничного отдела – на 5,3 % (4,2 % для алендроната) (р < 0,0002 во всех точках). Исследование DECIDE показало быстрое снижение МКР при лечении деносумабом. Максимальное снижение составило в первый месяц для маркеров костной резорбции CTX-1 89 % против 61 % для алендроната (р < 0,0001), к третьему месяцу – 89 % против 66 % (р < 0,0001), на шестом месяце, перед тем как деносумаб вводили повторно, – 77 % против 73 %, хотя различия оставались достоверными (р = 0,0001). На девятом месяце, спустя три месяца после получения второй дозы деносумаба, – 89 % против 76 % (р < 0,0001), на двенадцатом месяце средние показатели снижения были похожими в обеих группах CTX-1 – 74 % в группе деносумаба против 76 % в группе алендроната (р = 0,52). Максимальное снижение CTX-1 на фоне приема алендроната отмечено через 3 месяца лечения и сохранялось постоянным на протяжении всего периода лечения.
Снижение показателей маркеров костного формирования аминотерминального пропептида протоколлагена I типа (P1NP) также было более значимо в группе деносумаба (р < 0,0001). Содержание P1NP в группе принимавших деносумаб в первый месяц снизилось на 26 % против 11 % для принимавших алендронат. Максимальное снижение P1NP было зарегистрировано через 3 месяца – на 76 % в группе деносумаба против 56 % в группе алендроната и сохранялось на протяжении 12 месяцев лечения (72 % против 65 % на алендронате). В группе, получавшей алендронат, максимальное снижение P1NP отмечено через 9 месяцев лечения (на 65 % против 78 % в группе деносумаба).
По данным авторов, это первое опубликованное сравнительное исследование алендроната и деносумаба, в котором зафиксировано преимущество деносумаба более быстро и выраженно тормозить костную резорбцию, а также более значимо повышать МПК на всех участках скелета по сравнению с алендронатом. Испытуемые показали хорошую переносимость обоих препаратов. Большинство НЯ были расценены исследователями как слабой или умеренной степени тяжести. Процент НЯ, расцененных исследователями как связанные с препаратами, был сходным в обеих группах (17 % для деносумаба и 18,3 %, для алендроната). Число серьезных нежелательных явлений (СНЯ) также было схожим (n = 34 (5,7 %) в группе деносумаба и n = 37 (6,3 %) в группе алендроната).
Не было различий между группами в частоте и характере инфекционных НЯ. СНЯ, обусловленные инфекционными заболеваниями, зарегистрированы у 9 (1,5 %) пациенток, получавших деносумаб, и у 6 (1 %) женщин из группы алендроната. Также не было различий в частоте злокачественных новообразований в группах: у 6 (1 %) женщин из группы деносумаба и 5 (0,9 %) из группы алендроната. Исследование DECIDE показало, что у пациентов, переведенных с алендроната на деносумаб, отмечалось значительное улучшение МПК во всех основных отделах скелета. Существенных различий в частоте и общей структуре НЯ между двумя препаратами отмечено не было. В этом исследовании 77 % пациентов высказались в пользу инъекций деносумаба каждые 6 месяцев по сравнению с еженедельным приемом таблеток.
Наиболее крупное международное рандомизированное плацебоконтролируемое исследование III фазы, получившее название FREEDOM, было направлено на оценку эффективности и безопасности деносумаба для предотвращения переломов у 7868 женщин, больных постменопаузальным остеопорозом. Испытуемые получали 60 мг деносумаба (3933 чел.) или плацебо (3935 чел.) подкожно каждые 6 месяцев в течение 3 лет. В исследовании принимали участие женщины в возрасте от 60 до 90 лет с Т-показателем поясничного отдела и бедра, составляющим от –2,5 до –4,0. Средний возраст женщин составил 72,3 года. Средняя минеральная плотность костной ткани поясничного отдела соответствовала остеопорозу и составляла –2,8 (Т-критерий); средние показатели бедра соответствовали остеопении: общее бедро —1,9, шейка бедра —2,2. Около 24 % женщин имели переломы позвонков до начала исследования. Из общего числа 6478 испытуемых (82 %) закончили 36 месяцев исследования 5979 (76 %) и получили инъекции полностью.
Первой конечной точкой исследования было возникновение нового перелома позвонка. Вторичной конечной точкой считались переломы костей периферического скелета и перелом бедра. Данные по переломам позвонков составляли с учетом рентгенограмм, сделанных в начале исследования и хотя бы единожды после. Введение деносумаба подкожно дважды в год в течение трех лет значительно снижало риск позвоночных, невертебральных и переломов бедра. Снижение риска позвоночных переломов было примерно равным в первый и последующие годы применения препарата. В целом за три года деносумаб снизил относительный риск переломов позвонков на 68 %, невертебральных – на 20 %, переломов бедра – на 40 % по сравнению с группой плацебо. В группах с повышенным риском также происходило снижение частоты переломов, как и у испытуемых в общем исследовании. Терапия деносумабом в течение 36 месяцев сопровождалась увеличением МПК поясничного отдела на 9,2 %, МПК бедра на 6,0 %.
По сравнению с группой плацебо, на фоне лечения деносумабом отмечено снижение уровня маркеров костной резорбции: СТХ на 86 % через 1 месяц после инъекции, на 72 % перед повторной инъекцией (через 6 месяцев лечения). Уровень маркеров формирования Р1NP снизился на 18, 50 и 76 % соответственно по отношению к показателям группы плацебо. В целом у пациентов, принимавших деносумаб и плацебо, количество НЯ и СНЯ, а также случаев приостановления исследования из-за НЯ было приблизительно равным. Также не наблюдалось существенной разницы в количестве случаев онкологических и сердечно-сосудистых заболеваний; случаев инфекционных заболеваний средней и повышенной тяжести. В группе принимавших деносумаб зафиксировано 4 случая инфекций, вызываемых условно-патогенными организмами, в группе принимавших плацебо – 3. Количество смертей в группе принимавших деносумаб – 70 (1,8 %), в группе принимавших плацебо – 90 (2,3 %). Ни в одной из групп не был зафиксирован остеонекроз нижней челюсти. Замедленное заживление переломов обнаружилось у 2 пациентов, принимавших деносумаб, и у 4, принимавших плацебо. В группе принимавших плацебо был один случай несрастания перелома плечевой кости. Гипокальцемия в группе принимавших деносумаб составила 0 %, в группе принимавших плацебо – 0,1 % (3 случая).
Очаговые реакции на инъекции исследуемого препарата проявились у 33 пациентов в группе принимавших деносумаб (0,8 %) и у 26 (0,7 %) пациенток, принимавших плацебо. Нейтрализующие антитела на деносумаб не выявлены ни у одного пациента. Экзема наблюдалась у 3,0 % принимавших деносумаб и у 1,7 % принимавших плацебо. Метеоризм среди принимавших деносумаб наблюдался чаще, чем у принимавших плацебо (2,2 % против 1,4 %). В группе принимавших деносумаб зарегистрировано 12 случаев СНЯ, обусловленных воспалительными процессами подкожно-жировой клетчатки (целлюлитом), и у одной пациентки, получавшей плацебо. Общее число заболеваний целлюлитом в обеих группах приблизительно равно (47 чел. (1,2 %) – деносумаб, 36 чел. (0,9 %) – плацебо). В исследовании FREEDOM было установлено, что деносумаб в дозе 60 мг подкожно один раз в 6 месяцев в течение 3 лет снижал риск переломов позвоночника, переломов периферических костей скелета, а также переломов бедра у женщин с ПМО. Значимого различия между группами деносумаба и плацебо в общей статистике злокачественных новообразований, инфекций, осложнений со стороны сердечно-сосудистой системы не было. Роста частоты гипокальциемии или отсроченного срастания переломов не наблюдалось.
Последствия смены препаратов, в особенности принимая во внимание длительное сохранение бисфосфонатов в позвоночнике, безопасность и эффективность различных антирезобтивных агентов после терапии алендронатом, составляют особый клинический интерес. Исследование III фазы перехода от алендроната к деносумабу STAND – рандомизированное двойное слепое, двойное маскированное с использованием параллельных групп. В исследование были включены 504 женщины в постменопаузе, которые прежде принимали алендронат хотя бы 6 месяцев. Цель исследования – оценить эффект перехода с алендроната на деносумаб. Средний возраст женщин составил 67,6 года, а длительность менопаузы – 19,3 года. У 50 % женщин ранее случались переломы, обусловленные остеопорозом. Все пациентки каждый день принимали 1000 мг элементарного кальция и хотя бы 400 МЕ витамина D. Показатели МПК T-критерия были от –2,0 до –4,0. 481 пациентка (95,4 %) закончила исследование.
Переход на деносумаб через 12 месяцев привел к увеличению МПК в поясничном отделе позвоночника, общем показателе бедра и в дистальном отделе лучевой кости, а также к снижению МКР в большей степени по сравнению с пациентками, продолжавшими терапию алендронатом. Случаев гипокальцемии не выявлено, а НЯ были схожи. Лечение деносумабом привело к более выраженному увеличению МПК, чем продолженная терапия алендронатом на всех оцененных участках скелета. Переход с долгосрочной терапии алендронатом на деносумаб привел к значительному и динамичному снижению костного ремоделирования, характеризующегося стремительным спадом в начале, переходящим в постепенное ослабление эффекта к концу дозового интервала. Снижение интенсивности костного ремоделирования на фоне деносумаба сопровождалось увеличением МПК. Деносумаб и алендронат характеризовались похожими профилями безопасности. Переход с одного препарата на другой не вызвал острых проблем. Около 80 % пациенток указали на предпочтение и большую удовлетворенность лечением путем подкожного введения препарата каждые 6 месяцев, по сравнению с еженедельным приемом таблеток.
Лекарственная форма и состав – раствор для подкожного введения, 1 мл. Каждый предварительно заполненный шприц содержит:
– активное вещество – деносумаб (60 мг);
– вспомогательные вещества – сорбитол (Е420) – 47 мг; уксусная кислота ледяная – 1 мг; полисорбат 20 – 0,1 мг; натрия гидроксид – до рН 5,0–5,5; вода для инъекций – до 1 мл.
Фармакологическое действие
Фармакологическое действие – ингибирующее костную резорбцию.
Фармакокинетика
При п/к введении деносумаб характеризуется нелинейной фармакокинетикой, дозозависимой в широком диапазоне доз, и дозозависимым увеличением экспозиции для дозы в 60 мг (или 1 мг/кг) и выше.
Всасывание
После п/к введения деносумаба в дозе 60 мг биодоступность составила 61 % и Cmax – 6 мкг/мл (диапазон 1–17 мкг/мл), данные параметры наблюдались через 10 дней (диапазон 2–28 дней). После достижения Cmax содержание препарата в сыворотке крови снижалось с T1/2 26 дней (диапазон 6–52 дня) и далее в течение 3 мес. (диапазон 1,5–4,5 мес.). У 53 % пациентов деносумаб не обнаруживался в сыворотке крови после 6 мес. от последнего введения препарата.
Распределение
Не наблюдалось изменений фармакокинетических параметров деносумаба, а также кумуляции за все время приема многократных доз препарата по 60 мг каждые 6 мес.
Метаболизм
Деносумаб состоит из аминокислот и углеводов, как обычный иммуноглобулин. На основании данных доклинических исследований ожидается, что метаболизм деносумаба будет происходить по пути клиренса иммуноглобулинов, результатом которого будет распад на небольшие пептидные цепи и отдельные аминокислоты.
Выведение
На основании доклинических данных выведение деносумаба будет происходить по пути выведения всех иммуноглобулинов, результатом которого будет распад на небольшие пептидные цепи и отдельные аминокислоты.
Отдельные группы пациентов
Пациенты пожилого возраста (65 лет или старше). Возраст не оказывает значимого влияния на фармакокинетику деносумаба, по данным фармакокинетического анализа в популяции пациентов от 28 до 87 лет.
Дети и подростки (до 18 лет). Фармакокинетика у детей не изучалась.
Расовая принадлежность. Фармакокинетика деносумаба не зависит от расовой принадлежности.
Пациенты с почечной недостаточностью. В исследовании данных 55 пациентов с различной степенью почечной недостаточности, включая пациентов, находящихся на диализе, степень почечной недостаточности не оказывала влияния на фармакокинетику и фармакодинамику деносумаба, поэтому не требуется коррекция режима дозирования деносумаба при хронической почечной недостаточности.
Хроническая печеночная недостаточность. Исследований влияния недостаточности функции печени на фармакокинетику деносумаба не проводилось.
Показания препарата пролиа
? лечение постменопаузального остеопороза;
? лечение потери костной массы у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы и у мужчин, с раком предстательной железы, получающих гормон-депривационную терапию.
Противопоказания
? повышенная чувствительность к любому из компонентов препарата;
? гипокальциемия.
Применение при беременности и кормлении грудью
Нет каких-либо данных по применению препарата во время беременности. Пролиа не рекомендуется для применения у беременных женщин.
В токсикологических исследованиях на низших приматах было показано, что в дозах, 100-кратно превышающих рекомендуемые для клинического применения, деносумаб не оказывал влияния на фертильность или развитие плода.
Эксперименты на мышах с выключенным геном показали, что отсутствие RANKL может приводить к нарушению развития лимфатических узлов у плода, а в постнатальном периоде может быть причиной нарушения прорезывания зубов и роста костей; также возможно влияние на созревание молочной железы, что может приводить к ослаблению лактации.
Пациенткам, у которых беременность наступила во время лечения препаратом пролиа, следует зарегистрироваться в Программе наблюдения беременности компании «Амджен». Пациенты или врачи, у которых они находятся под наблюдением, могут позвонить по телефону, указанному в конце настоящей инструкции для регистрации в Программе наблюдения.
Неизвестно, выводится ли деносумаб в грудное молоко. Поскольку известно, что потенциально деносумаб может вызывать нежелательные реакции у детей грудного возраста, необходимо или прекратить грудное вскармливание, или отменить препарат.
Побочные действия
Данные, полученные при контролируемом применении в клинических исследованиях.
Нежелательные реакции приводятся по классам систем органов в терминах Медицинского словаря регуляторной деятельности (MedDRA).
Частота возникновения определена следующим образом: очень часто – >1 из 10; часто – >1 из 100 и <1 из 10; нечасто – >1 из 1000 и <1 из 100; редко – >1 из 10 000 и <1 из 1000; очень редко <1 из 10 000.
В каждой группе систем органов и частоты сообщений нежелательные реакции приводятся по убыванию степени серьезности (см. табл. 15).
Таблица 15
Частота нежелательных реакций на препарат пролиа
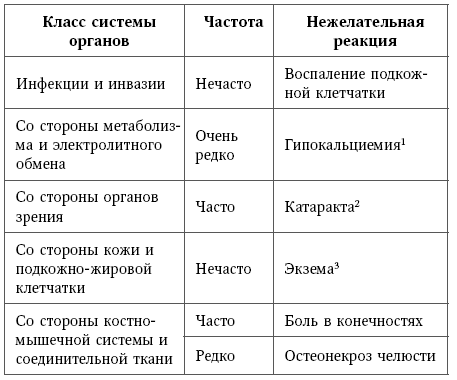
1 Cм. раздел «Особые указания».
2 У мужчин, получающих андрогендепривационную терапию по поводу рака предстательной железы.
3 Включая дерматиты, аллергические дерматиты, атопический дерматит, контактный дерматит.
Способ применения и дозы
Введение
Проведение инъекции препарата требует предварительного обучения – см. рекомендации по введению препарата, приведенные в конце настоящего раздела.
Доза
Рекомендуемая доза препарата пролиа – одна п/к инъекция 60 мг каждые 6 мес. В течение курса лечения рекомендуется дополнительно принимать препараты кальция и витамин D.
Применение у отдельных групп пациентов
Дети. Препарат пролиа не рекомендован к применению в педиатрии, так как эффективность и безопасность данного препарата не изучались в этой возрастной группе.
Пациенты пожилого возраста. Основываясь на имеющихся данных об эффективности и безопасности препарата в данной возрастной группе, не требуется коррекция режима дозирования препарата (см. «Фармакокинетика», Отдельные группы пациентов).
Почечная недостаточность
Основываясь на имеющихся данных об эффективности и безопасности препарата в данной группе пациентов, не требуется коррекция режима дозирования препарата (см. «Фармакокинетика», Отдельные группы пациентов).
У пациентов с тяжелой почечной недостаточностью (Cl креатинина <30 мл/мин) или находящихся на диализе существует большой риск развития гипокальциемии. Таким пациентам необходимо дополнительно принимать препараты кальция и витамин D.
Печеночная недостаточность
Эффективность и безопасность не изучались.
Инструкция по использованию
Следует оценить раствор перед введением на предмет наличия включений или изменения цвета. Раствор нельзя использовать при помутнении или изменении цвета. Не встряхивать.
Чтобы избежать дискомфорта в месте введения, следует согреть раствор до комнатной температуры (до 25 °C) перед инъекцией, а затем медленно ввести все содержимое предварительно заполненного шприца. Шприц с остатками препарата выбросить. Подробные рекомендации по самостоятельному п/к введению препарата включены в данную инструкцию по медицинскому применению.
Любые количества неиспользованного препарата или неиспользованные материалы должны быть уничтожены в соответствии с местными требованиями.
Передозировка
В клинических исследованиях не отмечено случаев передозировки препарата.
В клинических исследованиях вводили дозы деносумаба до 180 мг каждые 4 недели (кумулятивная доза до 1080 мг в 6 мес.).
Особые указания
Рекомендуется прием препаратов кальция и витамина D во время применения препарата пролиа.
Гипокальциемия может быть скорректирована приемом препаратов кальция и витамина D в адекватных дозах перед началом терапии деносумабом. Рекомендуется контроль концентрации кальция у пациентов, предрасположенных к гипокальциемии (см. «Побочные действия»).
У пациентов, получающих препарат пролиа, могут развиться инфекции кожи и ее придатков (преимущественно воспаление подкожной клетчатки), в отдельных случаях требующие госпитализации. О таких реакциях чаще сообщалось для группы деносумаба (0,4 %), чем группы плацебо (0,1 %) (см. «Побочные действия»). При этом общая частота возникновения кожных инфекций сравнима в группах деносумаба и плацебо. Пациентов следует проинструктировать о необходимости незамедлительно обратиться за врачебной помощью в случае развития симптомов и признаков воспаления подкожной клетчатки.
У пациентов с распространенным раком, получавших 120 мг деносумаба каждые 4 недели, сообщалось о развитии случаев остеонекроза челюсти. Имеются отдельные сообщения о развитии остеонекроза челюсти при дозе 60 мг каждые 6 мес. (см. «Побочные действия»).
Лица с аллергией на латекс не должны касаться резинового колпачка иглы (производное латекса).
Влияние на способность к вождению автотранспорта и обращению с техникой. Исследований влияния на способность к вождению автотранспортных средств и управлению механизмами не проводилось.
Деносумаб и кардиоваскулярный риск
RANKL и ОПГ могут также играть роль в регуляции процессов кальцификации сосудов. У мышей с выключенным геном (knocked-out) ОПГ развивается обширный сосудистый кальциноз. ОПГ синтезируется местно в эндотелиальных клетках и может способствовать их выживаемости, снижая минерализацию атерогенных отложений. Различные клинические исследования показали, что уровень циркулирующего ОПГ выше у пациентов с сердечно-сосудистыми заболеваниями, особенно при терминальной стадии почечной недостаточности, его уровень повышается в ответ на воспаление. В одном из исследований на людях, наоборот, была выявлена обратная связь между уровнем ОПГ и эхогенностью каротидных бляшек, т. е. у лиц с более выраженным фиброзом и кальцинозом наблюдалось снижение сывороточной концентрации ОПГ. Ингибирование RANKL снижает интенсивность сосудистой кальцификации у трансгенных мышей (knocked-in), имеющих человеческий ген RANKL, при наличии глюкокортикоид-индуцированного остеопороза. Таким образом, помимо ожидаемого протективного влияния на костную ткань, деносумаб может снижать риск атеросклероза. Клинические исследования по эффективности лечения остеопороза и остеопении не выявили различий в количестве кардиоваскулярных событий у пациентов, принимавших деносумаб. Тем не менее это не являлось конечной точкой при оформлении исследования, а отмеченный кардиоваскулярный риск был невысоким (у 6,8 % пациентов в группе плацебо исследования FREEDOM наблюдались сердечно-сосудистые осложнения, инсульты, ИБС и заболевания периферических сосудов). Было бы интересно оценить подгруппы высокого риска с учетом сердечно-сосудистых осложнений в качестве конечной точки исследований по остеопении и остеопорозу, при их проведении у пациентов с повышенным риском атероматоза и глюкокортикоид-индуцированного остеопороза.
Больше книг — больше знаний!
Заберите 20% скидку на все книги Литрес с нашим промокодом
ПОЛУЧИТЬ СКИДКУ