Терапия
Терапия
Как указывают эксперты ВОЗ (1997), для новорожденных, не имеющих клинических признаков гипогликемии (бессимптомное течение), концентрация глюкозы крови должна поддерживаться более 2,6 ммоль/л. По мнению экспертов ААП (1993, 2005): «Ни одно исследование не показало, что лечение бессимптомной гипогликемии имеет лучшие краткосрочные или долгосрочные результаты, чем исход без лечения…. Кроме того, нет доказательств того, что младенцы с бессимптомной гипогликемией имеют пользу от лечения… или добавок, таких как вода, глюкоза, молочные смеси или другие жидкости». На наш взгляд, это очень взвешенный и правильный подход. Но при этом необходимо помнить, что такой ребенок требует очень тщательного наблюдения, поскольку, несмотря на отсутствие симптоматики гипогликемии у новорожденного происходит усиленная выработка катехоламинов, что приводит к снижению перистальтики кишечника, перевариванию лактозы, а, соответственно, снижению образования глюкозы.
Таблица 7 Время выявления гипогликемий у новорожденных (Alet Н. et al., 1987)
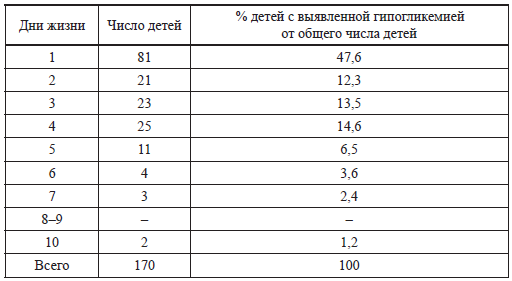
Если концентрация глюкозы крови у новорожденного ребенка ниже 2,6 ммоль/л, то эксперты ВОЗ (1997) рекомендуют:
• Новорожденный должен получать питание. Если же он не может находиться на грудном вскармливании, то ему можно давать молоко (смесь) из бутылочки или через зонд.
• Измерение глюкозы крови должно быть повторено через 1 час и перед следующим кормлением (через 3 часа). Если концентрация глюкозы менее 2,6 ммоль/л, то надо рассматривать вопрос о внутривенном введении глюкозы.
• Если средства для внутривенного введения глюкозы отсутствуют или недоступны, то дополнительное питание нужно дать через зонд.
• Грудное вскармливание должно продолжаться.
Имеются разные точки зрения на то, при каком уровне глюкозы крови должно быть начато парентеральное введение растворов глюкозы (декстрозы). Подробно об этом рассказано выше. В нашей стране [18] парентеральное введение растворов глюкозы начинают при ее концентрации в крови менее 2,6 ммоль/л (как и в большинстве европейских стран и США). Хотелось бы отметить, что в большинстве стран мира применяют растворы декстрозы (с буфером, нейтрализующим соляную кислоту, стабилизатор), из-за низкого pH растворов глюкозы (около 3,0). Иначе это может способствовать прогрессированию метаболического ацидоза, особенно у больных детей. Как правило, в наших клиниках этому факту вообще не придают никакого значения, начиная лечить ацидоз введением соды. Но можно взять и прочесть аннотацию этого препарата, а потом подумать, что мы делаем с нашими детьми?.. Вероятно, съездам, обществам врачей необходимо обращаться к руководству нашей страны для решения этого вопроса (выпуску или закупке растворов декстрозы для лечения новорожденных детей), хотя необходимо отметить, что локально в некоторых клиниках этот вопрос решен.
Имеются две тактики при начале парентерального введения глюкозы (декстрозы) для коррекции гипогликемий у новорожденных. Первая. Раствор глюкозы начинают вводить из расчета 0,4–0,8 г/кг (2–4 мл 20 %-го или 4–8 мл 10 %-го, что предпочтительнее, раствора глюкозы на кг массы тела) со скоростью не более 1,0 мл в минуту в течение 5 минут. Такая тактика у американских педиатров получила название «миниболюс» [130]. Затем переходят на постоянную внутривенную инфузию глюкозы со скоростью 2,4–4,6 мл/кг-час (4–8 мг/кг-мин) 10 % раствором глюкозы. При этом нужно учитывать, что новорожденные с различной патологией имеют неодинаковые потребности в экзогенной глюкозе (табл. 8). Концентрация глюкозы крови должна быть определена через 30 минут после начала терапии. Вторая тактика или подход. По мнению некоторых исследователей, он является более предпочтительным, поскольку не создает резких перепадов осмолярности плазмы крови, хотя чаще всего и позволяет добиться нормогликемии через более длительное время. Хотя это время занимает всего 5-10 минут. Но кто знает, сколько должна продолжаться гипогликемия, чтобы поразить нейроны? При этом необходимо помнить, что, кроме гиперосмии при «миниболюсе», возможно развитие чрезмерно быстрой утилизации глюкозы, стойкого гиперинсулинизма, нарушения обмена веществ (метаболический ацидоз, гиперкапния, высокая концентрация лактата, а по прошествии времени жировая инфильтрация органов и ожирение). Суть второго подхода проста: постоянная инфузия глюкозы (декстрозы) из расчета 6–8 мг/кг мин.
Если гипогликемия сохраняется, то скорость инфузии может быть увеличена до 10 мл/кг-час (15 мг/кг-мин) 10 %-го раствора глюкозы. У ребенка, получающего вышеуказанную терапию, должна мониторироваться глюкоза крови, так как возможно развитие гипергликемий и всех вышеуказанных осложнений.
Если для создания или поддержания нормогликемии требуется инфузия глюкозы более 15 мг/кг-мин, то дальнейшее увеличение скорости и концентрации вводимой глюкозы нежелательно. В этом случае ребенку должны вводиться контринсулярные препараты, способствующие увеличению концентрации глюкозы крови. При этом необходимо помнить два обстоятельства. Во-первых, нельзя допускать гипергликемии (повышение концентрации глюкозы крови более 4,5 ммоль/л (80 мг/%)). Во-вторых, ребенок должен получать полноценное энтеральное питание с высоким содержанием лактозы. Лактоза предпочтительнее, чем сахароза, поскольку не вызывает стимуляции выработки инсулина. Среди контринсулярных препаратов, которые могут быть назначены новорожденным детям, следующие:
глюкагон (0,1–0,5 мг/кг внутримышечно 2 раза в сутки). Может назначаться длительно. Побочные эффекты глюкагона: рвота, диарея, гипокалиемия. В высоких дозах стимулирует выработку инсулина [153].
гидрокортизон (5-10 мг/кг в сутки) или преднизолон (2–3 мг/кг в сутки). Гормон необходимо использовать, если гипогликемия не поддается терапии внутривенной инфузией глюкозы в течение 24–48 часов.
Таблица 8 Потребности в глюкозе у различных групп новорожденных (сводные литературные данные)
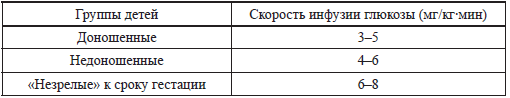
Глюкокортикоиды в данной ситуации не могут быть использованы более 2 суток. Более того, при назначении глюкокортикоидов необходимо помнить об их возможном негативном влиянии на ЦНС и кардиомиоциты новорожденных детей. Подробно этот вопрос освещен в нашей монографии «Интенсивная терапия и транспортировка новорожденных детей» [4].
Диазоксид (гиперстат) (суточная доза 5-15 мг/кг с возможным увеличением до 20–25 мг/кг внутрь 3 раза в сутки). Диазоксид связываясь с АВСС8 субъединицей калиевых АТФ-зависимых каналов, увеличивает проницаемость канала, приводя к гиперполяризации клеточной мембраны, тем самым тормозя высвобождение инсулина. При назначении диазоксида всегда должны быть назначены диуретики (есть зарубежные рекомендации по применению тиазидных диуретиков), поскольку при его назначении возможна задержка жидкости и развитие отеков за счет задержки натрия в организме [111]. Кроме того, являясь достаточно мощным дилататором, диазоксид снижает периферическое сосудистое сопротивление, расширяя артериолы. Несколько слов о гидрохлортиазиде, рекомендуемом некоторыми авторами в качестве мочегонного средства [10]. Дело в том, что еще недавно в число противопоказаний для его назначения входили беременность, кормление грудью, возраст до 3 лет из-за его возможных тератогенных эффектов. В последнее время противопоказания для его назначения несколько изменились [14]. К ним относятся: детский возраст до 3 лет (таблетированные формы). Противопоказано применение препарата в I триместре беременности. Во II и III триместрах беременности применение препарата возможно только в том случае, когда предполагаемая польза для матери превосходит потенциальный риск для плода. Гидрохлордиазид проникает через плацентарный барьер. Существует опасность желтухи плода или новорожденных, тромбоцитопении и других последствий. Препарат выделяется с грудным молоком. При необходимости применения препарата в период лактации следует решить вопрос о прекращении грудного вскармливания. Другие тиазидные или тиазидоподобные диуретики, включая арифон, равел и т. д. вообще запрещены детям до 18 лет, беременным женщинам и кормящим грудью матерям. Представляется, что необходимы дальнейшие исследования по этому вопросу, а в настоящее время при необходимости использования диуретиков применять препараты других групп, разрешенные в неонатальный период в нашей стране.
Соматостатин (октреотид) (2–8 мкг/кг*мин внутривенно капельно). Он подавляет секрецию инсулина, связываясь с рецепторами ?-клеток и блокируя внутриклеточные сигнальные пути. Фармакологическая эффективность соматостатина достаточно кратковременна. После болюсного введения он подавляет секрецию инсулина на три часа. Соматостатин подавляет секрецию гипоталамусом соматотропин-рилизинг-гормона и секрецию передней долей гипофиза соматотропного и тиреотропного гормонов. Кроме того, он подавляет также секрецию различных гормонально активных пептидов и серотонина, продуцируемых в желудке, кишечнике, печени и поджелудочной железе. В частности, он понижает секрецию глюкагона, гастрина, холецистокинина, вазоактивного интестинального пептида, инсулиноподобного фактора роста-1. Ингибирование глюкагона и гормона роста приводит к некоторому снижению продукции глюкозы в печени, поэтому одновременное назначение глюкагона и/или гормона роста потенцирует эффект соматостатина. Кратковременный эффект соматостатина в настоящее время преодолевают за счет непрерывных подкожных инъекций с помощью портативных насосов [85, 111].
Некоторые авторы [111] указывают, что нифедипин, ингибируя приток кальция в ?-клетки, подавляет секрецию инсулина. In vitro , этот препарат эффективно подавляет секрецию инсулина, однако in vivo нифедипин в обычных дозах крайне редко бывает эффективным, а при увеличении дозы развиваются побочные эффекты.
В конце прошлого века определенные надежды при лечении гипогликемии возлагались на рекомбинантный инсулиноподобный фактор роста. Однако терапевтический эффект указанного препарата подтвержден не был [121].
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Терапия
Терапия Как указывают эксперты ВОЗ (1997), для новорожденных, не имеющих клинических признаков гипогликемии (бессимптомное течение), концентрация глюкозы крови должна поддерживаться более 2,6 ммоль/л. По мнению экспертов ААП (1993, 2005): «Ни одно исследование не показало, что
Терапия
Терапия Не смотря на более чем 25-летнее использование инсулина в неонатальной практике для коррекции гипергликемии, в большинстве центров первым решением врача при выявлении повышенной концентрации глюкозы в плазме крови у новорожденных является снижении скорости или
Терапия
Терапия Основным лекарственным препаратом для лечения данного заболевания является инсулин. Пероральные сахаропонижающие препараты в настоящее время не используются. Не существует единого мнения о пути введения и дозе инсулина. Например, французские педиатры (PolakM., Cave
9.8. Терапия
9.8. Терапия Терапия синдрома КРБС включает методы устранения боли; воздействия, направленные на нормализацию вегетативных симпатических функций и лечение фонового заболевания или нарушения, вызвавшего этот синдром (Bonica J. J., 1990; Stanton- Hicks M., 1998).Одним из самых существенных и
Медикаментозная терапия
Медикаментозная терапия Консервативная терапия, направленная на активизацию процесса рассасывания спаек, заключается в назначении противовоспалительных препаратов,
3.12.2. Стандартная терапия (СД-II)
3.12.2. Стандартная терапия (СД-II) По предписанию вашего врача, вы принимаете лекарства или инсулин, или и то и другое, и компенсируете их «сахаропонижающий» эффект преимущественно углеводной диетой. (При СД-I – прием инсулина обязателен всю жизнь).По мере неизбежного на
Гормонозаместительная терапия
Гормонозаместительная терапия Вокруг гормонозаместительной терапии (ГЗТ) ведутся жаркие споры. В 2002 году Мировое медицинское исследовательское общество выяснило, что гормонозаместительные препараты увеличивают риск рака молочной железы, болезней сердца, инсульта и
Электромагнитная терапия
Электромагнитная терапия Одним из распространенных методов профилактики и лечения варикозного расширения является электромагнитная терапия. Этот метод, в отличие от других, направленных на удаление пораженной вены, влияет на центральные механизмы развития
Шоколадная терапия
Шоколадная терапия В последнее время шоколадная косметика и косметические процедуры с использованием шоколада заняли одно из ведущих мест по степени их востребованности. Медицина уже давно отметила тот факт, что вкус и аромат шоколада способствуют поднятию настроения,
ЦВЕТОВАЯ ТЕРАПИЯ
ЦВЕТОВАЯ ТЕРАПИЯ С давних времен известно, что определенные сочетания цветов могут вызвать различные заболевания и, наоборот, избавить от дискомфорта. В настоящее время хромотерапия (лечение цветом) является одной из популярных отраслей альтернативной медицины.
Эфферентная терапия
Эфферентная терапия Она представляет собой комплекс мероприятий, способствующих удалению вредных веществ из организма. Среди ее методов следует назвать гемосорбцию, плазмоферез, наружную и внутрикишечную сорбцию. С помощью указанных методов токсичные вещества
БАЗИСНАЯ ТЕРАПИЯ
БАЗИСНАЯ ТЕРАПИЯ На практике не всегда удается провести все элиминационные мероприятия, поэтому и необходимо применять лекарственные препараты, подавляющие аллергическое воспаление в бронхах. Эти препараты делятся на две группы: негормональные и гормональные.Они не
Стоун-терапия
Стоун-терапия Кому, хотя раз приходилось понежиться на горячих камнях, поймет, почему эта оздоровительная методика пользуется таким огромным спросом на оздоровительных СПА-курортах и в центрах.Стоун-терапия не менее древняя методика лечения, чем, скажем, гидротерапия
Мануальная терапия
Мануальная терапия Что такое мануальная терапия?Мануальная терапия (от латинского manus – рука) – это древняя наука, вобравшая в себя опыт тысячелетий. Как таковая мануальная терапия известна уже в V веке, со времен Гиппократа. Она представляет собой набор механических
Симптоматическая терапия
Симптоматическая терапия При развитии судорожного синдрома прежде всего следует восстановить проходимость дыхательных путей и ввести внутривенно по 1,5–3 мл 5 % раствора диазепама (седуксена) на 10 кг живого веса.При развитии синдрома гипертермии центрального
Пет-терапия
Пет-терапия Еще во времена Гиппократа было известно, что домашние животные благоприятно влияют на здоровье человека. Однако термин «пет-терапия» появился сравнительно недавно — в середине XX века. Именно тогда детский психиатр из США Борис Левинсон обратил внимание на