2. Парентеральное питание
2. Парентеральное питание
При тяжелых заболеваниях, сопровождающихся выраженными нарушениями гомеостаза, необходимо обеспечить организм энергетическим и пластическим материалом. Поэтому, когда питание через рот по каким-либо причинам нарушено или совсем невозможно, необходимо переводить больного на парентеральное питание.
При критических состояниях различной этиологии самые значительные изменения происходят в метаболизме белков – наблюдается интенсивный протеолиз, особенно в поперечнополосатой мускулатуре.
В зависимости от тяжести протекающего процесса белки организма катаболизируются в количестве 75—150 г в сутки (суточные потери белка приведены в таблице 11). Это ведет к дефициту незаменимых аминокислот, которые используются в качестве источника энергии в процессе гликонеогенеза, что приводит к отрицательному азотистому балансу.
Таблица 11
Суточные потери белка в критических состояниях
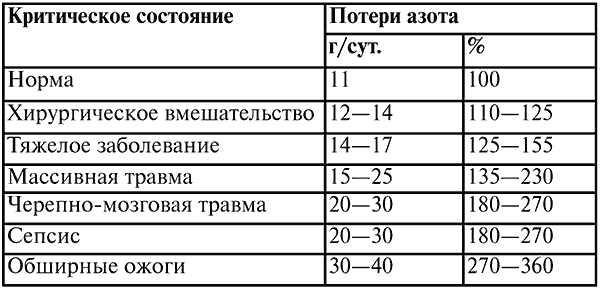
Потеря азота приводит к уменьшению массы тела, так как: 1 г азота = 6,25 г белка (аминокислот) = 25 г мышечной ткани. Уже через сутки от начала критического состояния без адекватной терапии с введением достаточного количества основных питательных веществ исчерпываются собственные запасы углеводов, и организм получает энергию от белков и жиров. В связи с этим осуществляются не только количественные, но и качественные изменения метаболических процессов.
Основными показаниями для проведения парентерального питания являются:
1) аномалии развития желудочно-кишечного тракта (атрезия пищевода, стеноз привратника и другие, пред– и послеоперационный период);
2) ожоги и травмы ротовой полости и глотки;
3) обширные ожоги тела;
4) перитонит;
5) паралитическая непроходимость кишечника;
6) высокие кишечные свищи;
7) неукротимая рвота;
8) коматозное состояние;
9) тяжелые заболевания, сопровождающиеся усилением катаболических процессов и декомпенсированными нарушениями метаболизма (сепсис, тяжелые формы пневмонии); 10)атрофия и дистрофия;
11) анорексия в связи с неврозами.
Парентеральное питание должно проводиться в условиях компенсации волемических, водно-электролитных нарушений, ликвидации расстройств микроциркуляции, гипоксемии, метаболического ацидоза.
Основной принцип парентерального питания – обеспечение организма адекватным количеством энергии и белка.
С целью парентерального питания применяют следующие растворы.
Углеводы: наиболее приемлемым препаратом, применяемым в любом возрасте, является глюкоза. Соотношение углеводов в суточном рационе должно быть не менее 50–60 %. Для полной утилизации требуется выдержать скорость введения, снабжать глюкозу следует ингредиентами – инсулин 1 ЕД на 4 г, калий, коферменты, участвующие в утилизации энергии: пиридоксальфосфат, кокарбоксилаза, липоевая кислота, а также АТФ – 0,5–1 мг/кг в сутки внутривенно.
При правильном введении высококонцентрированная глюкоза не вызывает осмотического диуреза и значительного повышения уровня сахара крови. Для проведения азотистого питания применяют либо высококачественные белковые гидролизаты (аминозол, аминон), либо растворы кристаллических аминокислот. В этих препаратах удачно сочетаются незаменимые и заменимые аминокислоты, они малотоксичны и редко вызывают аллергическую реакцию.
Дозы вводимых белковых препаратов зависят от степени нарушения белкового обмена. При компенсированных нарушениях доза вводимого белка – 1 г/кг массы тела в сутки. Декомпенсация белкового обмена, выражающаяся гипопротеинемией, снижением альбумин-глобулинового коэффициента, повышением мочевины в суточной моче, требует введения повышенных доз белка (3–4 г/кг в сутки) и проведения антикатаболической терапии. Сюда включают анаболитические гормоны (ретаболил, нераболил – 25 мг внутримышечно 1 раз в 5–7 дней), построение программы парентерального питания в режиме гипералиментации (140–150 ккал/кг массы в сутки), ингибиторы протеаз (контрикал, трасилол 1000 ЕД/кг в сутки в течение 5–7 дней). Для адекватного усвоения пластического материала каждый грамм вводимого азота необходимо обеспечить 200–220 ккал. Не следует вводить растворы аминокислот с концентрированными растворами глюкозы, так как они образуют токсические смеси.
Относительные противопоказания к введению аминокислот: почечная и печеночная недостаточность, шок и гипоксия.
Для коррекции жирового обмена и повышения калорийности парентерального питания применяются жировые эмульсии, содержащие полиненасыщенные жирные кислоты.
Жир является наиболее калорийным продуктом, однако для его утилизации необходимо выдерживать оптимальные дозы и скорость введения. Жировые эмульсии не должны вводиться вместе с концентрированными полиионными растворами глюкозы, а также перед и вслед за ними.
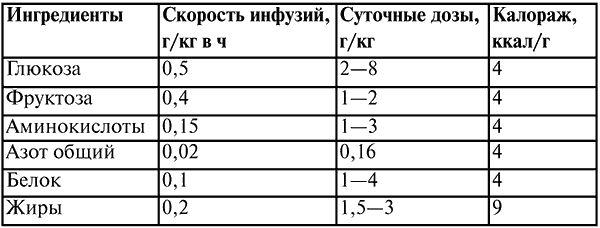
Противопоказания для введения жировых эмульсий: печеночная недостаточность, липемия, гипоксемия, шоковые состояния, тромбогеморрагический синдром, расстройства микроциркуляции, отек мозга, геморрагические диатезы. Необходимые данные основных ингредиентов по парентеральному питанию приведены в таблице 12 и таблице 13.
Таблица 12
Дозы, скорость, калораж основных ингредиентов для парентерального питания
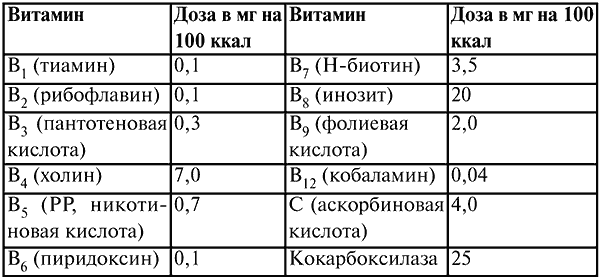
При назначении парентерального питания необходимо вводить оптимальные дозы витаминов, которые участвуют во многих обменных процессах, являясь коферментами в реакциях утилизации энергии.
Таблица 13
Дозы витаминов (в мг на 100 ккал), необходимые при проведении парентерального питания
Программа парентерального питания, проводимого в любом режиме, должна быть составлена в условиях сбалансированного соотношения ингредиентов. Оптимальное соотношение белков, жиров, углеводов – 1: 1,8: 5,6. Для расщепления и включения белков, жиров и углеводов в процессе синтеза необходимо определенное количество воды.
Соотношение между потребностью в воде и калорийностью пищи составляет 1 мл Н2О – 1 ккал (1: 1).
Расчет потребности энергозатраты покоя (ЭЗП) по Харрису– Бенедикту:
Мужчины – ЭЗП = 66,5 + 13,7 ? масса, кг + 5 ? рост, см – 6,8 ? возраст (годы).
Женщины – ЭЗП = 66,5 + 9,6 ? масса, кг + 1,8 ? рост, см – 4,7 ? возраст (годы).
Величина ЭЗП, определенная по формуле Харриса—Бенедикта, составляет в среднем 25 ккал/кг в сут. После проведенного расчета выбирают фактор физической активности больного (ФФА), фактор метаболической активности (ФМА), основанный на клиническом статусе, и температурный фактор (ТФ), с помощью которых будет определена потребность в энергии (ПЭ) конкретного больного. Коэффициент для расчета ФФА, ФМА и ТФ приведены в таблице 14.
Таблица 14
Коэффициент для расчета ФФА, ФМА и ТФ

Для определения суточной ПЭ умножают величину ЭЗП на ФФА, на ФМА и на ТФ.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
2. Парентеральное питание
2. Парентеральное питание При тяжелых заболеваниях, сопровождающихся выраженными нарушениями гомеостаза, необходимо обеспечить организм энергетическим и пластическим материалом. Поэтому, когда питание через рот по каким-либо причинам нарушено или совсем невозможно,
Глава 14 Энтеральное и парентеральное питание
Глава 14 Энтеральное и парентеральное питание Искусственное питание является сегодня одним из базисных видов лечения больных в условиях стационара. Практически не существует области медицины, в которой оно бы не применялось. Наиболее актуальна искусственная
Парентеральное питание
Парентеральное питание Под парентеральным питанием (ПП) понимают способ введения необходимых организму нутриентов, исключающий желудочно-кишечный тракт, непосредственно во внутренние среды организма (как правило, в сосудистое русло).ПП может быть полным (тотальным),
ПИТАНИЕ
ПИТАНИЕ О правилах правильного питания сейчас говорят и пишут столько, что если бы все эти письмена сложить вместе, то получилась бы огромная гора. Казалось бы, коль существует столько разумных толкований правил питания, то уже не должно быть никаких вопросов. Но увы. Этих
Питание
Питание Как семейный врач, я провел много времени, убеждая своих пациентов в необходимости правильно питаться или сесть на диету, чтобы бороться с воспалением. Существуют продукты питания, которые способны замедлить воспалительные процессы в организме и таким образом
ПИТАНИЕ
ПИТАНИЕ ВЛИЯНИЕ ХАРАКТЕРА ПИТАНИЯ НА СОСТОЯНИЕ ЗДОРОВЬЯОдним из источников энергии, поступающей в организм, является пища. Почему так огромно влияние характера питания на состояние здоровья? Дело в том, что развитие человечества, цивилизации привело к тому что оно стало
Питание
Питание Всё необходимое вашему будущему ребёнку в течение девяти месяцев беременности доставляет ваш организм.Как и всякий живой организм ваш ребёнок для собственного развития нуждается в энергии (калориях) и питательных веществах (протеин, липиды, глюциды, витамины,
Питание
Питание Чтобы вы не выбрали, грудь или из бутылочки, питание для развития малыша играет основополагающую роль. Оно ему доставляет при этом удовольствие, к которому вы имеете прямое отношение…Для родителей главной заботой является правильное питание их дитя, поскольку
Питание
Питание Принципы правильного питания Для повышения иммунитета необходимо правильное полноценное питание. Неполноценный пищевой белок калечит иммунную систему. Существуют белки, содержащие аминокислоты, которые не могут быть заменены никакими другими аминокислотами.
Питание
Питание В отличие от времен нашей ранней юности, а также теплого времени года, одного только увлажнения (даже очень щедрого) для ухода за кожей недостаточно. Молодая и жирная кожа питает себя сама. Сухая же (какой становится с возрастом, то есть после 25 лет, любая кожа)
Питание
Питание Рацион ребенка, зараженного вирусом краснухи, по качественному и количественному составу сходен с нормальным.При развитии болезни (особенно в острый период) диетологи советуют увеличить употребление продуктов, содержащих витамины, минералы и другие полезные
Питание
Питание Выбор вида диеты при коклюше зачастую обусловлен степенью тяжести развития болезни и возрастом ребенка. Питание в острый период должно быть дробным, то есть небольшими порциями, до 5–6 раз в день. Питье – обильное, в теплом виде. В случае рвоты пищу ребенку
Питание
Питание В первые 5–7 дней от начала заболевания дети, как правило, отказываются от приема пищи. Лучше всего в данный период предложить ребенку обильное питье и легкие слизистые супы. В качестве напитков подойдут отвар плодов шиповника, жидкий кисель, чай с лимоном, соки из